Γεγονότα για το θείο 1
Το θείο είναι το 16 στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία θείου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Θείο Περιοδικού Πίνακα Κυψέλη
Βασικά στοιχεία για το θείο
Όνομα: Θείο
Ατομικός αριθμός: 16
Σύμβολο στοιχείου: S
Ομάδα: 16
Περίοδος: 3
Αποκλεισμός: p
Οικογένεια στοιχείων: Μη μέταλλο
Ατομική μάζα: [32.059; 32.076]
Κατευθυντήριες γραμμές της IUPAC που αντικατοπτρίζουν το φυσικό και χημικό ιστορικό του δείγματος μαγνησίου. Εάν χρειάζεται μία μόνο τιμή της ατομικής μάζας, χρησιμοποιήστε 32.066.
Διαμόρφωση ηλεκτρονίου: [Ne]3s3p (συντομογραφία) ή 1s2s2p3s3p(πλήρη)
Ανακάλυψη: Αρχαία χρόνια
Οι άνθρωποι γνώριζαν για το θείο από την αρχαιότητα. Είναι ένα από τα λίγα στοιχεία που μπορούν να βρεθούν σε εγγενή μορφή. Το θείο είναι γνωστό με πολλά ονόματα:sufra (αραβική λέξη για το κίτρινο), θειάφι, shulbari (σανσκριτικά για «εχθρός του χαλκού») και sulfurium (λατινικά). Αναγνωρίστηκε ως στοιχείο από τον Γάλλο χημικό Antoine Lavoisier το 1789.
Προέλευση ονόματος: Το θείο ελήφθη από τη λατινική ορθογραφία του sulfurium. Το επίθημα -ium έπεσε επειδή το θείο δεν ήταν μέταλλο.
Ορθογραφία: Το f in θείο υιοθετήθηκε επίσημα από την IUPAC το 1990. Το θείο χρησιμοποιήθηκε από Βρετανούς χημικούς από τον 19ο αιώνα. Το 1992, η Βασιλική Εταιρεία επισημοποίησε τη βρετανική ορθογραφία σε θείο.
Ισότοπα:
Το φυσικό θείο αποτελείται από τέσσερα σταθερά ισότοπα:S, S, S και S. Υπάρχουν είκοσι ένα ραδιενεργά ισότοπα που κυμαίνονται από S έως S.
Το S
Το Sulphur-32 είναι ένα σταθερό ισότοπο που περιέχει 16 νετρόνια. Το 95,02% του φυσικού θείου είναι θείο-32.
Το S
Το Sulphur-33 είναι ένα σταθερό ισότοπο που περιέχει 17 νετρόνια. Το 0,75% του φυσικού θείου είναι θείο-33.
Το S
Το Sulphur-34 είναι ένα σταθερό ισότοπο που περιέχει 18 νετρόνια. Το 4,21% του φυσικού θείου είναι θείο-34.
Το S
Το Sulphur-36 είναι ένα σταθερό ισότοπο που περιέχει 20 νετρόνια. Το 0,02% του φυσικού θείου είναι θείο-36.
Το S
Το Sulphur-35 είναι ένα ραδιενεργό ισότοπο που περιέχει 19 νετρόνια. Το θείο-35 διασπάται με β- διασπάται σε Cl με χρόνο ημιζωής 87,51 ημέρες. Αυτό το ισότοπο μπορεί να βρεθεί φυσικά σε ίχνη.

Μικροί κρύσταλλοι θείου. Πίστωση:Ben Mills/Public Domain)
Φυσικά δεδομένα
Πυκνότητα: 2,07 g/cm
Σημείο τήξης: 388,36 K(115,21 °C, 239,38 °F)
Σημείο βρασμού: 717,8 K(444,6 °C, 832,3 °F)
Κρίσιμο σημείο: 1314 K στα 20,7 MPa
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 1,727 kJ/mol
Θερμότητα εξάτμισης: 45 kJ/mol
Μοριακή θερμική χωρητικότητα: 22,75 J/mol·K
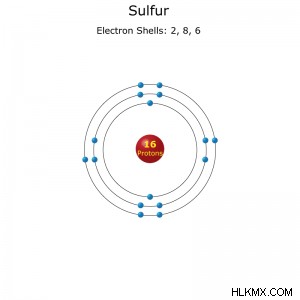
Διαμόρφωση κελύφους ηλεκτρονίων ενός ατόμου θείου.
Ατομικά δεδομένα
Ατομική ακτίνα: 1,80 Å
Ομοιοπολική ακτίνα: 1,05 Å
Ακτίνα Van der Waals: 1,80 Å
Συγγένεια ηλεκτρονίων: 200,41 kJ/mol
Ηλεκτραρνητικότητα: 2,58
1 Ενέργεια ιονισμού: 999,589 kJ/mol
2 Ενέργεια ιονισμού: 2251.763 kJ/mol
3 Ενέργεια ιονισμού: 3356,72 kJ/mol
4 Ενέργεια ιονισμού: 4556,231 kJ/mol
5 Ενέργεια ιονισμού: 7004,305 kJ/mol
6 Ενέργεια ιονισμού: 8495,824 kJ/mol
7 Ενέργεια ιονισμού: 27107,363 kJ/mol
8 Ενέργεια ιονισμού: 31719,56 kJ/mol
Κατάσταση οξείδωσης: +6, +4, +2 (κοινό), +5, +3, +1, -1, -2 (ασυνήθιστο)

Κορυφή:Τήξη θείου. Το λιωμένο υγρό θείο είναι ένα κόκκινο χρώμα του αίματος. Κάτω:Το θείο καίγεται με μπλε φλόγα. Προσφορά:Johannes Hemmerlein/Άδεια GNU
Διασκεδαστικά στοιχεία για το θείο
- Το θείο εμφανίζεται ελεύθερα στη φύση ως εγγενές στοιχείο.
- Το θείο γίνεται κόκκινο όταν λιώνει.
- Το θείο καίγεται με μπλε φλόγα.
- Το θείο έχει τον μεγαλύτερο αριθμό αλλοτρόπων από οποιοδήποτε στοιχείο. Υπάρχουν 30 γνωστά αλλότροπα, αλλά οι εύθραυστοι κίτρινοι κρύσταλλοι είναι οι πιο συνηθισμένοι.
- Το θείο χρησιμοποιείται για τον βουλκανισμό του καουτσούκ.
- Το θείο μπορεί να χρησιμοποιηθεί ως αντισηπτικό και αντιμυκητιακό.
- Το μεγαλύτερο μέρος του θείου χρησιμοποιείται για την παρασκευή θειικού οξέος.
- Πολλές ενώσεις θείου είναι τοξικές. Το υδρόθειο νεκρώνει την όσφρησή σας και μπορεί να προκαλέσει αναπνευστική παράλυση και θάνατο.
- Το θείο εξορύσσεται από θόλους αλατιού με ώθηση του ατμού σε πηγάδια. Ο ατμός λιώνει το θείο και το υγρό νερό και το θείο αντλούνται έξω.
- Μια άλλη πηγή θείου είναι η αφαίρεσή του ως υποπροϊόν της διύλισης πετρελαίου.
- Το θείο δεν έχει μυρωδιά. Η μυρωδιά που σχετίζεται γενικά με το θείο είναι στην πραγματικότητα από ενώσεις θείου.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




