Στοιχεία για το χλώριο 1
Το χλώριο είναι το 17 στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία χλωρίου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Κύτταρο περιοδικού πίνακα χλωρίου
Βασικά στοιχεία για το χλώριο
Όνομα: Χλώριο
Ατομικός αριθμός: 17
Σύμβολο στοιχείου: Cl
Ομάδα: 17
Περίοδος: 3
Αποκλεισμός: p
Οικογένεια στοιχείων: Αλογόνο
Ατομική μάζα: [35.446; 35.457]
Κατευθυντήριες γραμμές της IUPAC που αντικατοπτρίζουν το φυσικό και χημικό ιστορικό του δείγματος μαγνησίου. Εάν απαιτείται μία μόνο τιμή της ατομικής μάζας, χρησιμοποιήστε 35,4527.
Διαμόρφωση ηλεκτρονίου: [Ne]3s3p (συντομογραφία) ή 1s2s2p3s3p (πλήρη)
Ανακάλυψη: Ο Carl Wilhelm Scheele το 1774
Ο Scheele απομόνωσε χλώριο από υδροχλωρικό οξύ. Σκέφτηκε ότι το κίτρινο αέριο που συγκέντρωσε ήταν ένα οξείδιο μιας άλλης ένωσης, όχι ένα νέο στοιχείο. Αυτή η πεποίθηση συνεχίστηκε μέχρι το 1811 όταν ο Sir Humphry Davy έδειξε ότι δεν υπήρχε οξυγόνο στο αέριο χλώριο. Το χλώριο ήταν το δικό του στοιχείο.
Προέλευση ονόματος: Ο Davy ονόμασε το νέο στοιχείο χλώριο από την ελληνική λέξη chloros που σημαίνει κιτρινοπράσινο.
Ισότοπα:
Το φυσικό χλώριο αποτελείται από δύο σταθερά ισότοπα:το Cl και το Cl. Υπάρχουν είκοσι δύο ραδιενεργά ισότοπα που κυμαίνονται από Cl έως Cl.
Cl
Το χλώριο-35 είναι ένα σταθερό ισότοπο που περιέχει 18 νετρόνια. Το 75,77% του φυσικού χλωρίου είναι χλώριο-35.
Cl
Το χλώριο-37 είναι ένα σταθερό ισότοπο που περιέχει 20 νετρόνια. Το 24,23% του φυσικού χλωρίου είναι χλώριο-37.
Cl
Το χλώριο-36 είναι ένα ραδιενεργό ισότοπο που περιέχει 19 νετρόνια. Σχηματίζεται όταν η κοσμική ακτινοβολία αλληλεπιδρά με το χλώριο της ατμόσφαιρας. Το χλώριο-36 διασπάται με β- διάσπαση σε Ar 98,1% του χρόνου ή S με σύλληψη ηλεκτρονίων το 1,9% του χρόνου. Ο χρόνος ημιζωής είναι 301.200 χρόνια και μπορεί να βρεθεί φυσικά σε ίχνη.

Υγρό χλώριο σε φιάλη. Μονάδα:Workingclass91/Creative Commons
Φυσικά δεδομένα
Πυκνότητα:
(αέριο) 0,002898 g/cm (υγρό σε σημείο βρασμού) 1,5625 g/cm
Σημείο τήξης: 171,6 K(−101,5 °C, −150,7 °F)
Σημείο βρασμού: 239,11 K(−34,04 °C, −29,27 °F)
Κρίσιμο σημείο: 416,9 K στα 7,991 MPa
Κατάσταση στους 20ºC: Αέριο
Heat of Fusion: 6,406 kJ/mol για Cl2
Θερμότητα εξάτμισης: 20,41 kJ/mol για Cl2
Μοριακή θερμική χωρητικότητα: 33.949 J/mol·K για Cl2
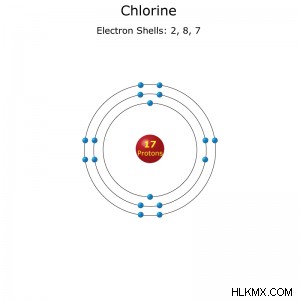
Διαμόρφωση κελύφους ηλεκτρονίων ενός ατόμου χλωρίου.
Ατομικά δεδομένα
Ατομική ακτίνα: 1,75 Å
Ομοιοπολική ακτίνα: 1,02 Å
Ακτίνα Van der Waals: 1,75 Å
Συγγένεια ηλεκτρονίων: 348,575 kJ/mol
Ηλεκτραρνητικότητα: 3.16
1 Ενέργεια Ιονισμού: 1251,186 kJ/mol
2 Ενέργεια Ιονισμού: 2297,663 kJ/mol
3 Ενέργεια Ιονισμού: 3821,78 kJ/mol
4 Ενέργεια Ιονισμού: 5158,608 kJ/mol
5 Ενέργεια Ιονισμού: 6541,7 kJ/mol
6 Ενέργεια Ιονισμού: 9361,97 kJ/mol
7 Ενέργεια Ιονισμού: 11018,221 kJ/mol
8 Ενέργεια Ιονισμού: 33603,91 kJ/mol
Καταστάσεις οξείδωσης: +7, +5, +1, -1 (κοινό), +6, +6, +2 (ασυνήθιστο)
Διασκεδαστικά στοιχεία για το χλώριο
- Το χλώριο σπάνια εμφανίζεται ελεύθερα στη φύση. Είναι πολύ πιο πιθανό να βρείτε το χλώριο σε συνδυασμό με άλλα στοιχεία (όπως το επιτραπέζιο αλάτι NaCl) ή το ίδιο με τη μορφή Cl2 .
- Το χλώριο είναι το τρίτο πιο άφθονο στοιχείο στους ωκεανούς της Γης.
- Το χλώριο είναι το 21ο πιο άφθονο στοιχείο στον φλοιό της Γης.
- Το χλώριο είναι το ένατο πιο άφθονο στοιχείο στο ανθρώπινο σώμα.
- Το αέριο χλώριο έχει κιτρινοπράσινο χρώμα και έντονη μυρωδιά.
- Η μυρωδιά του χλωρίου είναι ερεθιστική. Οι άνθρωποι μπορούν να ανιχνεύσουν τη μυρωδιά σε συγκεντρώσεις τόσο χαμηλές όσο 3,5 μέρη ανά εκατομμύριο.
- Το χλώριο ήταν ένα πρώιμο χημικό όπλο. Αντιδρά με τους βλεννογόνους και μπορεί να κάψει το δέρμα. Οι συγκεντρώσεις γύρω στα 1000 μέρη ανά εκατομμύριο είναι συνήθως θανατηφόρες μετά από μερικές αναπνοές. Το αέριο χλώριο είναι επίσης πιο πυκνό από τον αέρα και θα καθιζάνει σε χαμηλές περιοχές όπως ορύγματα και αλεπούλες.
- Τα δοχεία με διαρροή χλωρίου είναι επικίνδυνα. Διαρροές σε δοχεία ανιχνεύονται με χρήση αμμωνίας. Η αμμωνία αντιδρά με το χλώριο και σχηματίζει μια λευκή ομίχλη κοντά στη διαρροή.
- Το χλώριο εμφανίζεται συχνά σε αντιδράσεις οργανικής χημείας όπου αντικαθιστά τα άτομα υδρογόνου στα μόρια.
- Το χλώριο χρησιμοποιείται στην κατασκευή πληθώρας προϊόντων όπως πλαστικά, χαρτί, φάρμακα, εντομοκτόνα, απολυμαντικά, υφάσματα, βαφές και προϊόντα πετρελαίου. Εξάγεται στο εμπόριο με ηλεκτρόλυση από διαλύματα άλμης.
- Το όνομα του Scheele για το χλώριο ήταν muriaticum. Η παλιά ονομασία για το υδροχλωρικό οξύ ήταν μουριατικό οξύ.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




