Γεγονότα Κρυπτών – Ατομικός Αριθμός 36 Σύμβολο Στοιχείου Κρ

Το Κρυπτόν είναι το χημικό στοιχείο με σύμβολο Kr και ατομικό αριθμό 36. Όπως και τα άλλα ευγενή αέρια, είναι άχρωμο, άοσμο, άοσμο και μη τοξικό. Το Krypton είναι περισσότερο γνωστό για την παραγωγή του φωτεινού λευκού των φωτογραφικών φλας. Ακολουθεί μια συλλογή από ενδιαφέροντα γεγονότα για το κρυπτό, συμπεριλαμβανομένων των ατομικών δεδομένων, της ιστορίας, των χρήσεων και των πηγών του.
Στοιχεία για το στοιχείο Krypton
Όνομα: Κρυπτόν
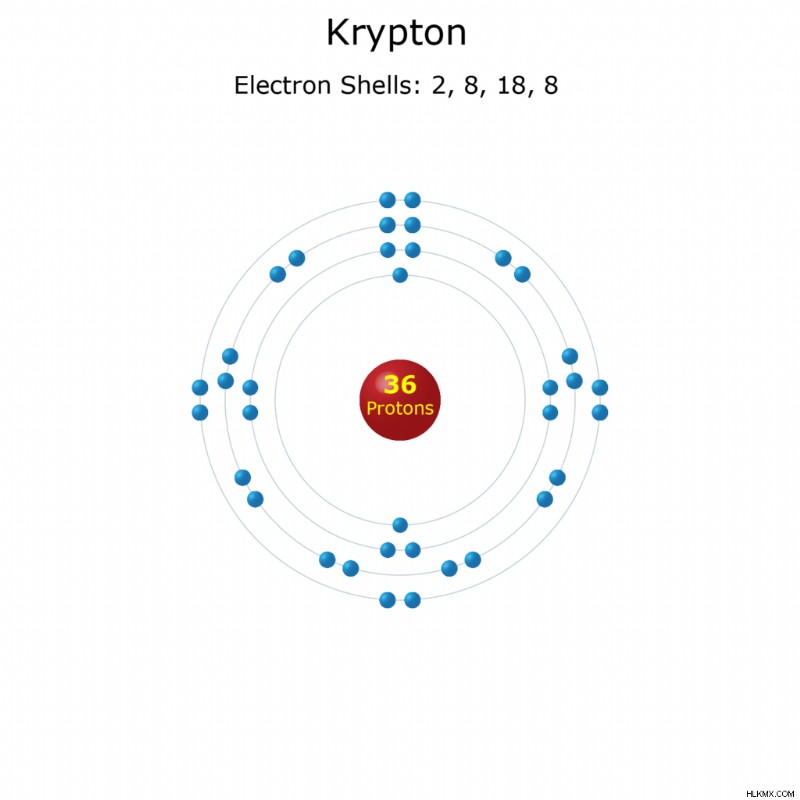
Ατομικός αριθμός: 36
Σύμβολο στοιχείου: Kr
Ατομικό βάρος: 83.798(2)
Εμφάνιση: Άχρωμο αέριο
Ομάδα: Ομάδα 18
Περίοδος: Περίοδος 4
Αποκλεισμός: p-block
Οικογένεια στοιχείων: Ευγενές αέριο
Διαμόρφωση ηλεκτρονίου: [Ar] 3d 4s 4p
Ηλεκτρόνια ανά κέλυφος: 2, 8, 18, 8
Ανακάλυψη: William Ramsay and Morris Travers (1898)
Προέλευση ονόματος: Ελληνικός κρυπτός :κρυφό

Ιστορία της Ανακάλυψης
Ο William Ramsay και ο βοηθός του Morris Travers ανακάλυψαν το κρυπτό το 1898 (Βρετανία). Απομόνωσαν το στοιχείο από τα υπολείμματα που απομένουν μετά την εξάτμιση άλλων συστατικών του υγρού αέρα. Η ίδια μέθοδος οδήγησε στην ανακάλυψη νέον, αργού και ξένον. Ο Ramsay ονόμασε το νέο στοιχείο κρυπτό από την ελληνική λέξη κρυπτός , που σημαίνει «κρυμμένο». Ο William Ramsay έλαβε το Νόμπελ Χημείας το 1904 για την ανακάλυψη των ευγενών αερίων και τη θέση τους στον περιοδικό πίνακα. Το μόνο φυσικό ευγενές αέριο που δεν ανακάλυψε ήταν το ραδόνιο, αλλά ήταν ο πρώτος που το απομόνωσε.
Ισότοπα Κρυπτών
Το φυσικό κρυπτό αποτελείται από πέντε σταθερά ισότοπα, συν ένα έκτο ισότοπο (Kr) που έχει τόσο μεγάλο χρόνο ημιζωής (9,2×10 έτη) που είναι ουσιαστικά σταθερό. Το πιο άφθονο ισότοπο είναι το Kr, το οποίο αντιπροσωπεύει το 56,99% του στοιχείου. Υπάρχουν περίπου τριάντα ισομερή και ασταθή ισότοπα.
Βιολογικός ρόλος και τοξικότητα
Το Κρύπτον δεν εξυπηρετεί κανένα βιολογικό ρόλο σε κανέναν οργανισμό. Ενώ θεωρείται μη τοξικό, το αέριο μπορεί να δράσει ως ασφυξιακό (παρόμοιο με το ήλιο) και ως ναρκωτικό. Η αναπνοή 50% αέρα με 50% κρυπτόν προκαλεί νάρκωση παρόμοια με τη νάρκωση αζώτου που βιώνουν οι αυτοδύτες σε βάθος 30 μέτρων (100 πόδια).
Πηγές του Krypton
Το Κρύπτον είναι ένα αρχέγονο στοιχείο. Με άλλα λόγια, το στοιχείο ήταν παρόν όταν σχηματίστηκε ο πλανήτης και έχει διατηρηθεί σε μεγάλο βαθμό. Η αφθονία του κρυπτονίου στην ατμόσφαιρα είναι περίπου 1 μέρος ανά εκατομμύριο. Εμπορικά, το κρυπτό λαμβάνεται με κλασματική απόσταξη υγροποιημένου αέρα.
Χρήσεις Krypton
Το ιονισμένο κρυπτό απελευθερώνει έντονο λευκό φως, έτσι το κρυπτό βρίσκει χρήση σε λαμπτήρες φωτογραφικού φλας, λαμπτήρες φθορισμού και φώτα νέον. Τα λέιζερ Krypton χρησιμοποιούνται σε εκθέσεις φωτός λέιζερ και στην έρευνα πυρηνικής σύντηξης. Τα ηλεκτρομαγνητικά θερμιδόμετρα χρησιμοποιούν υγρό κρυπτό. Τα ισότοπα βρίσκουν χρήση στην απεικόνιση μαγνητικού συντονισμού (MRI), στην υπολογιστική τομογραφία (CT) και στην πυρηνική ιατρική. Μερικές φορές τα τζάμια παραθύρων είναι μονωμένα με αέριο κρυπτόν μεταξύ των υαλοπινάκων. Το SpaceX χρησιμοποιεί κρυπτό ως προωθητικό για τους δορυφόρους Starlink.
Ενώσεις Κρυπτών
Το κρυπτόν και άλλα ευγενή αέρια είναι σχεδόν αδρανή, αλλά μπορούν να σχηματίσουν ενώσεις υπό ορισμένες συνθήκες. Η πιο σημαντική ένωση κρυπτονίου είναι το διφθοριούχο κρυπτό (KrF2 ), το οποίο χρησιμοποιείται σε λέιζερ φθοριούχου κρυπτού. Υδρίδιο κρυπτών (Kr(H2 )4 ) οι κρύσταλλοι αναπτύσσονται υπό πιέσεις μεγαλύτερες από 5 GPa. Τα πολυατομικά ιόντα περιλαμβάνουν τα ArKr, KrH και πιθανώς KrXe. Οι ασταθείς ενώσεις περιλαμβάνουν το Kr(OTeF5 )2 και [HC≡N–Kr–F].
Φυσικά δεδομένα
Πυκνότητα (στο STP): 3,749 g/L
Σημείο τήξης: 115,78 K (−157,37 °C, −251,27 °F)
Σημείο βρασμού: 119,93 K (−153,415 °C, −244,147 °F)
Τριπλό σημείο: 115,775 K, 73,53 kPa
Κρίσιμο σημείο: 209,48 K, 5,525 MPa
Κατάσταση στους 20ºC: αέριο
Heat of Fusion: 1,64 kJ/mol
Θερμότητα εξάτμισης: 9,08 kJ/mol
Μοριακή θερμική χωρητικότητα: 20,95 J/(mol·K)
Θερμική αγωγιμότητα: 9,43×10 W/(m·K)
Κρυσταλλική δομή: κεντραρισμένο κυβικό (fcc)
Μαγνητική σειρά: διαμαγνητικό
Ατομικά δεδομένα
Ομοιοπολική ακτίνα: 116±4 μ.μ.
Ακτίνα Van der Waals: 202 μ.μ.
Ηλεκτραρνητικότητα: Κλίμακα Pauling:3,00
1 Ενέργεια Ιονισμού: 1350,8 kJ/mol
2 Ενέργεια Ιονισμού: 2350,4 kJ/mol
3 Ενέργεια Ιονισμού: 3565 kJ/mol
Συνήθεις καταστάσεις οξείδωσης: Συνήθως 0, σπάνια +1 ή +2
Διασκεδαστικά στοιχεία για το Krypton
- Το συμπαγές κρυπτό είναι λευκό.
- Αν και το ιονισμένο κρυπτό φαίνεται λευκό, το στοιχείο έχει πολλές γραμμές φάσματος εκπομπής. Οι πιο έντονες γραμμές είναι το κίτρινο και το πράσινο.
- Λόγω της χαμηλής αντιδραστικότητάς του, το κρυπτόν διαφεύγει από τα επιφανειακά νερά. Διαρκεί πολύ περισσότερο στα υπόγεια ύδατα, επομένως το Kr μπορεί να χρησιμοποιηθεί για την χρονολόγηση υπόγειων υδάτων ηλικίας 50.000 έως 800.000 ετών.
- Η ανίχνευση του ισοτόπου krypton-85 στην ατμόσφαιρα οδήγησε στην ανακάλυψη μυστικών εγκαταστάσεων επανεπεξεργασίας πυρηνικών καυσίμων της Βόρειας Κορέας και του Πακιστάν.
- Το Krypton είναι ένα από τα προϊόντα από τη σχάση ουρανίου.
- Μέχρι το 1983, το μήκος του μετρητή οριζόταν με βάση το μήκος κύματος της πορτοκαλοκόκκινης φασματικής γραμμής krypton-86. (Ο μετρητής ορίζεται πλέον με βάση την ταχύτητα του φωτός.)
- Ένα λέιζερ κρυπτονίου-φθορίου μπορεί να παράγει παλμό που είναι περισσότερο από 500 φορές πιο ενεργητικός από όλη την ισχύ του ηλεκτρικού δικτύου των ΗΠΑ. Ωστόσο, ο παλμός είναι πολύ, πολύ σύντομος (4 δισεκατομμυριοστά του δευτερολέπτου).
Αναφορές
- Haynes, William M., ed. (2011). Εγχειρίδιο CRC Χημείας και Φυσικής (92η έκδ.). Boca Raton, FL:CRC Press. ISBN 1439855110.
- Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A. (2005). "Ευγενή αέρια". Εγκυκλοπαίδεια Χημικής Τεχνολογίας Kirk Othmer . Wiley. σελ. 343–383. doi:10.1002/0471238961.0701190508230114.a01
- Prusakov, V. N.; Sokolov, V. B. (1971). «Διφθοριούχο Κρυπτόν». Σοβιετική Ατομική Ενέργεια . 31 (3):990–999. doi:10.1007/BF01375764
- Wast, Robert (1984). Εγχειρίδιο CRC Χημείας και Φυσικής . Boca Raton, Florida:Chemical Rubber Company Publishing. σελ. Ε110. ISBN 0-8493-0464-4.




