Ορισμός αντίδρασης καύσης και παραδείγματα

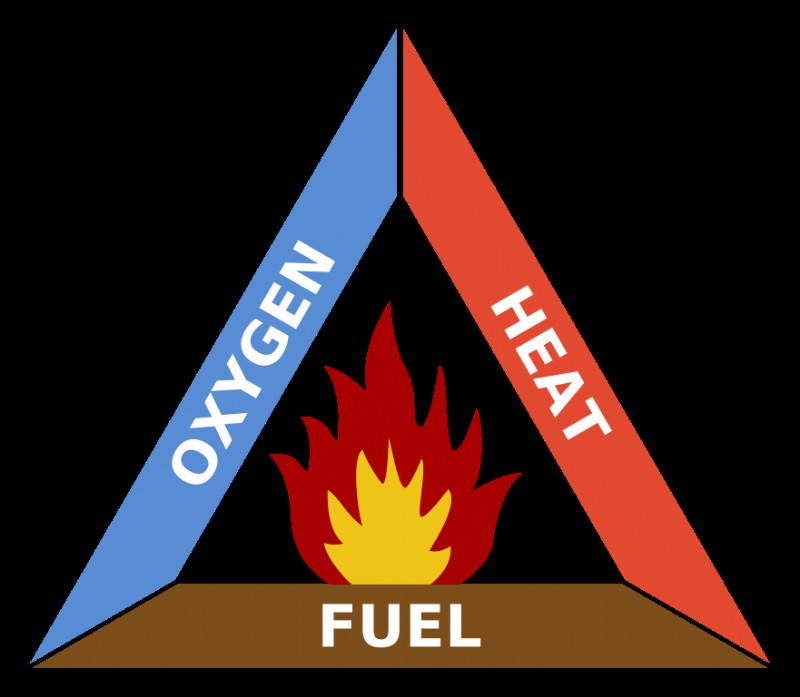
Μια καύση Η αντίδραση είναι μια εξώθερμη χημική αντίδραση μεταξύ ενός καυσίμου και ενός οξειδωτικού που σχηματίζει ένα οξειδωμένο προϊόν. Στη γενική χημεία, είναι ένας από τους κύριους τύπους χημικών αντιδράσεων. Η καύση είναι μια αντίδραση μεταξύ ενός καυσίμου υδρογονάνθρακα (π.χ. άνθρακας, προπάνιο, ξύλο, μεθάνιο) και μοριακού οξυγόνου (O2 ), παράγοντας διοξείδιο του άνθρακα (CO2). ), νερό (H2 Ο) και θερμότητα. Η θερμότητα παρέχει την ενέργεια ενεργοποίησης για την έναρξη της χημικής αντίδρασης. Ο συνδυασμός οξυγόνου, καυσίμου και θερμότητας σχηματίζει το τρίγωνο της φωτιάς , που είναι ένας τρόπος για να αναπαραστήσετε τις απαιτήσεις για την καύση.
Γενική εξίσωση αντίδρασης καύσης
Η γενική μορφή μιας αντίδρασης καύσης είναι:
υδρογονάνθρακας + οξυγόνο → διοξείδιο του άνθρακα + νερό + θερμότητα
Cx Hy + O2 → CO2 + H2 O
Παραδείγματα αντιδράσεων καύσης
Η καύση ονομάζεται επίσης καύση. Έτσι, οποιοδήποτε παράδειγμα καύσης μπορείτε να σκεφτείτε είναι μια αντίδραση καύσης, συμπεριλαμβανομένης της καύσης σπίρτων, κεριών, πυρκαγιών και καυστήρων αερίου. Ακολουθούν παραδείγματα ισορροπημένων εξισώσεων για αντιδράσεις καύσης:
- Κύση μεθανίου
CH4 (ζ) + 2 O2 (ζ) → CO2 (ζ) + 2 H2 O(g) - Κάψιμο ναφθαλίνης
C10 H8 + 12 O2 → 10 CO2 + 4 H2 O - Κύση αιθανίου
2 Γ2 H6 + 7 O2 → 4 CO2 + 6 H2 O - Κύση βουτανίου (συνήθως βρίσκεται στους αναπτήρες)
2C4 H10 (ζ) +13O2 (ζ) → 8CO2 (ζ) +10H2 O(g) - Κύση μεθανόλης (γνωστή και ως αλκοόλη ξύλου)
2CH3 OH(g) + 3O2 (ζ) → 2CO2 (ζ) + 4Η2 O(g) - Κύση προπανίου (χρησιμοποιείται σε ψησταριές αερίου, τζάκια και μερικές εστίες)
2C3 H8 (ζ) + 7O2 (ζ) → 6CO2 (ζ) + 8Η2 O(g)
Πώς να αναγνωρίσετε μια αντίδραση καύσης
Θα ξέρετε ότι έχετε μια αντίδραση καύσης όταν δείτε έναν υδρογονάνθρακα (μόριο που περιέχει άνθρακα και υδρογόνο) και αέριο οξυγόνο (O2 ) στην πλευρά του αντιδρώντος (αριστερή πλευρά) του βέλους αντίδρασης και διοξείδιο του άνθρακα (CO2 ) και νερό (H2 O) στην πλευρά του προϊόντος (δεξιά πλευρά) του βέλους αντίδρασης. Επίσης, η καύση με χρήση οξυγόνου παράγει πάντα θερμότητα. Η αντίδραση εξακολουθεί να απαιτεί ενέργεια ενεργοποίησης για να ξεκινήσει, αλλά περισσότερη θερμότητα απελευθερώνεται από την καύση από ό,τι απορροφάται κατά την εκκίνησή της.
Πολλές αντιδράσεις καύσης παράγουν φλόγες. Αν δείτε φωτιά, υποδηλώνει αντίδραση καύσης. Ωστόσο, η καύση γίνεται συχνά χωρίς φωτιά. Για παράδειγμα, το smoldering είναι καύση χωρίς φλόγες.
Μερικές φορές είναι πιο δύσκολο να αναγνωρίσουμε μια αντίδραση καύσης επειδή το αντιδρών περιέχει το δικό του οξειδωτικό (οξυγόνο) ή επειδή η καύση είναι ατελής, σχηματίζοντας άλλα προϊόντα εκτός από το διοξείδιο του άνθρακα και το νερό. Για παράδειγμα, ορισμένοι πύραυλοι βασίζονται στην αντίδραση μεταξύ του Aerozine 50 (C2 H12 N4 ) και τετροξείδιο του αζώτου (N2 O4 ). Εάν είστε έξυπνοι, θα δείτε ότι το Aerozine 50 περιέχει τους απαραίτητους χημικούς δεσμούς για να λειτουργήσει ως καύσιμο (άνθρακας-υδρογόνο και άνθρακας-άζωτο) και το τετροξείδιο του αζώτου παρέχει οξυγόνο για καύση.
Στη συνέχεια, υπάρχουν μορφές καύσης που δεν περιλαμβάνουν καν οξυγόνο.
Κύση χωρίς οξυγόνο
Τεχνικά, η οξείδωση δεν απαιτεί πάντα οξυγόνο, επομένως η καύση μπορεί να συμβεί και χωρίς οξυγόνο.
Ένα οξειδωτικό δέχεται ηλεκτρόνια, συνήθως παρέχοντας οξυγόνο σε μια χημική αντίδραση. Άλλα οξειδωτικά περιλαμβάνουν τα αλογόνα (φθόριο, χλώριο, κ.λπ.). Τα μεταλλικά καύσιμα καίγονται χρησιμοποιώντας φθοροπολυμερή (π.χ. Teflon, Viton), χωρίς να απαιτείται καθόλου οξυγόνο.
Πλήρης έναντι ατελούς καύσης
Όπως και άλλες χημικές αντιδράσεις, η καύση υπόκειται σε ένα περιοριστικό αντιδραστήριο και δεν ολοκληρώνεται πάντα.
- Πλήρης καύση ή «καθαρή καύση» συμβαίνει όταν η οξείδωση ενός υδρογονάνθρακα παράγει μόνο διοξείδιο του άνθρακα και νερό. Η καύση του κεριού είναι ένα καλό παράδειγμα πλήρους καύσης. Η θερμότητα από το φιτίλι που καίγεται εξατμίζει το κερί (έναν υδρογονάνθρακα). Το κερί αντιδρά με το οξυγόνο, απελευθερώνοντας διοξείδιο του άνθρακα και νερό. Το κερί καίγεται και το διοξείδιο του άνθρακα και το νερό διαχέονται στον αέρα.
- Ημιτελής καύση ή «βρώμικη καύση» είναι η ατελής οξείδωση των υδρογονανθράκων, που παράγει μονοξείδιο του άνθρακα (CO), άνθρακα (αιθάλη) και άλλα προϊόντα, εκτός από το διοξείδιο του άνθρακα και το νερό. Το ξύλο και τα περισσότερα ορυκτά καύσιμα υφίστανται ατελή καύση, απελευθερώνοντας αυτά τα πρόσθετα απόβλητα.
Αναφορές
- Lackner, Maximilian; Winter, Franz; Agarwal, Avinash K., eds. (2010). Εγχειρίδιο Καύσης . Wiley-VCH. ISBN 978-3-527-32449-1.
- Δίκαιο, Κ.Κ. (2006). Φυσική καύσης . Cambridge University Press. ISBN 9780521154215.
- Schmidt-Rohr, K (2015). «Γιατί οι καύσεις είναι πάντα εξώθερμες, αποδίδουν περίπου 418 kJ ανά mole O2 ". J. Chem. Εκπαιδεύω . 92 (12):2094–2099. doi:10.1021/acs.jchemed.5b00333




