Ιωνικοί δεσμοί εναντίον ομοιοπολικών δεσμών
Σε αυτό το άρθρο, συζητάμε τους ιοντικούς δεσμούς και τους ομοιοπολικούς δεσμούς και συγκρίνουμε ιονικούς δεσμούς έναντι ομοιοπολικών δεσμών . Θα μιλήσουμε για το τι είναι ιονικός δεσμός και τι είναι ομοιοπολικός δεσμός. Θα δώσουμε επίσης παραδείγματα και των δύο. Το κοινό επιτραπέζιο αλάτι είναι ένα παράδειγμα κοινής ένωσης με ιοντικούς δεσμούς. Οι ιοντικές ενώσεις είναι συχνά στερεές και σχηματίζουν κρυστάλλους.
Το διοξείδιο του άνθρακα, το αέριο που αναπνέουμε από τους πνεύμονές μας, είναι μια ένωση με ομοιοπολικούς δεσμούς. Ποια είναι όμως η διαφορά μεταξύ ιοντικού και ομοιοπολικού;
Τι είναι ο ομοιοπολικός δεσμός;
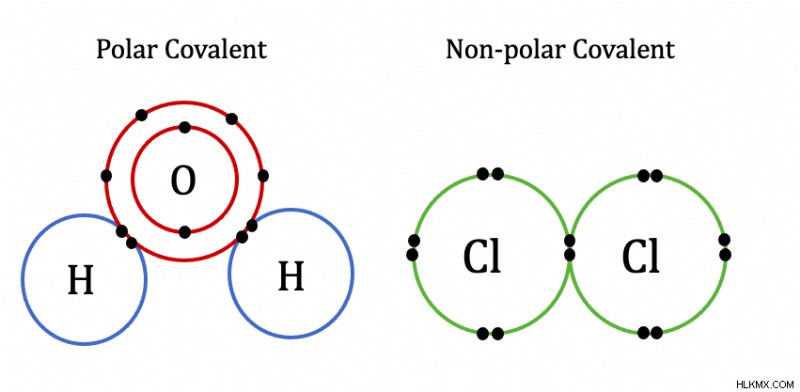
Τι είναι λοιπόν ο ομοιοπολικός δεσμός; Υπάρχουν δύο κύριοι τύποι χημικών δεσμών:οι ομοιοπολικοί δεσμοί και οι ιοντικοί δεσμοί. Ο ορισμός του ομοιοπολικού δεσμού , είναι ένας δεσμός όπου υπάρχουν ηλεκτρόνια μεταξύ των ατόμων που μοιράζονται αρκετά εξίσου. Όσο πιο ισότιμα μοιράζονται, τόσο πιο ομοιοπολικός χαρακτήρας το ομόλογο έχει.
Οι ομοιοπολικοί δεσμοί εμφανίζονται μεταξύ δύο αμέταλλων ή ενός μη μετάλλου και ενός μεταλλοειδούς. Υπάρχουν δύο τύποι ομοιοπολικών δεσμών:πολικός και μη πολικός. Οι δεσμοί μεταξύ μη μετάλλων ή ενός μη μετάλλου και ενός μεταλλοειδούς δεν έχουν μεγάλες διαφορές ηλεκτραρνητικότητας.
Πιο συγκεκριμένα, η διαφορά ηλεκτραρνητικότητας μεταξύ ατόμων σε ομοιοπολικούς δεσμούς δεν υπερβαίνει το 1,7. Ως αποτέλεσμα της παρόμοιας ηλεκτραρνητικότητας μεταξύ των ατόμων, τα άτομα μοιράζονται ηλεκτρόνια. Για παράδειγμα, τα ηλεκτρόνια σθένους στο οξυγόνο συμπληρώνουν την εξωτερική ηλεκτρονιακή στιβάδα του υδρογόνου. Ομοίως, το ηλεκτρόνιο σθένους στο υδρογόνο ολοκληρώνει το εξωτερικό κέλυφος ηλεκτρονίων του οξυγόνου. Υπάρχει μια αστεία εικόνα ομοιοπολικών δεσμών εδώ.
Ορισμός του Ionic
Ο ορισμός της λέξης «ιοντικό», είναι κάτι που σχετίζεται ή περιλαμβάνει ιόντα – τα οποία είναι φορτισμένα άτομα ή μόρια. Υπάρχουν ιοντικοί δεσμοί, ιοντικές ενώσεις, ιονισμός - όλες αυτές οι έννοιες περιλαμβάνουν ιόντα.
Τι είναι ένας ιοντικός δεσμός;
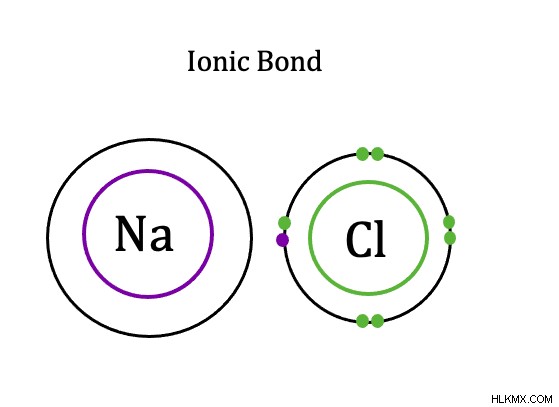
Τι είναι λοιπόν ένας ιοντικός δεσμός; Ο ορισμός του ιονικού δεσμού , είναι ένας δεσμός μεταξύ ατόμων όπου τα ηλεκτρόνια μεταφέρονται (κυρίως) από το ένα άτομο στο άλλο. Λέμε κυρίως, επειδή υπάρχει πάντα κάποια κατανομή ηλεκτρονίων μεταξύ των ατόμων, αλλά στους ιοντικούς δεσμούς, η κατανομή είναι πολύ άνιση. Όσο λιγότερο ίση είναι η κατανομή των ηλεκτρονίων, τόσο πιο ιονικός χαρακτήρας το ομόλογο έχει.
Οι ιονικοί δεσμοί εμφανίζονται μεταξύ ενός μετάλλου και ενός μη μετάλλου. Σε αντίθεση με τους ομοιοπολικούς δεσμούς, οι ιοντικοί δεσμοί μεταφέρουν τα ηλεκτρόνια σθένους μεταξύ των ατόμων. Στους ιοντικούς δεσμούς, η διαφορά ηλεκτραρνητικότητας μεταξύ μη μετάλλων και μετάλλων υπερβαίνει το 1,7. Το άτομο μετάλλου μεταφέρει τα ηλεκτρόνια του στο άτομο μη μετάλλου. Επομένως, το άτομο μετάλλου γίνεται θετικά φορτισμένο κατιόν και το άτομο μη μετάλλου γίνεται αρνητικά φορτισμένο ανιόν. Κατά συνέπεια, οι ιοντικοί δεσμοί δημιουργούν δύο φορτισμένα ιόντα, το μέταλλο δίνει πάντα το ηλεκτρόνιό του και το αμέταλλο δέχεται πάντα το ηλεκτρόνιο. Ένα παράδειγμα ιοντικού δεσμού είναι ο δεσμός στο χλωριούχο νάτριο, που είναι το αλάτι. Το ηλεκτρόνιο σθένους του νατρίου μεταφέρεται στο εξωτερικό κέλυφος ηλεκτρονίων του χλωριδίου.
Μόρια με ιοντικούς δεσμούς σχηματίζουν ιοντικές ενώσεις. Τα μόρια με ομοιοπολικούς δεσμούς σχηματίζουν ομοιοπολικές ενώσεις. Οι ομοιοπολικές ενώσεις συχνά λιώνουν σε χαμηλότερες θερμοκρασίες, επειδή οι ομοιοπολικοί δεσμοί τους σπάνε ευκολότερα. Ελπίζουμε ότι καταλαβαίνετε λίγο καλύτερα τώρα τους ιοντικούς και ομοιοπολικούς δεσμούς και ενώσεις.
Είναι το NaCl ιοντικό ή ομοιοπολικό;
Το NaCl, το χλωριούχο νάτριο ή το επιτραπέζιο αλάτι, είναι το «κλασικό» παράδειγμα μιας ιοντικής ένωσης. Το νάτριο είναι μέταλλο και το χλώριο είναι αμέταλλο. Έχει ιοντικούς δεσμούς, έχει κρυσταλλική δομή. Σε διάλυμα, διαχωρίζεται σε ιόντα στο διάλυμα.
Ιδιότητες ιοντικών ενώσεων
Διαφορές μεταξύ ενώσεων με ομοιοπολικούς και ιοντικούς δεσμούς
Ο ορισμός μιας ιοντικής ένωσης , είναι μια χημική ένωση που αποτελείται από ιόντα που συγκρατούνται μεταξύ τους με ηλεκτροστατικές δυνάμεις – βασικά συγκρατούνται μεταξύ τους με ιοντικούς δεσμούς. Σχηματίζονται από τακτοποιημένα συσκευασμένα ιόντα αντίθετου φορτίου. Η ένωση είναι ουδέτερη, αλλά αποτελείται από θετικά και αρνητικά φορτισμένα κατιόντα και ανιόντα. Ας δούμε μερικές διαφορές μεταξύ ιοντικών και ομοιοπολικών δεσμών και ενώσεων.
- Οι ιοντικοί δεσμοί τείνουν να μεταφέρουν ηλεκτρόνια, ενώ οι ομοιοπολικοί δεσμοί τα μοιράζονται πιο εύκολα
- Οι ιοντικές ενώσεις τείνουν να έχουν υψηλότερα σημεία τήξης και βρασμού, οι ομοιοπολικές ενώσεις έχουν χαμηλότερα σημεία τήξης και βρασμού
- Οι ιοντικές ενώσεις τείνουν να έχουν περισσότερα πολικά μόρια, οι ομοιοπολικές ενώσεις λιγότερο
- Οι οργανικές ενώσεις τείνουν να έχουν ομοιοπολικούς δεσμούς
- Οι ιοντικές ενώσεις βρίσκονται συνήθως μεταξύ ενός μετάλλου και ενός μη μετάλλου. Οι ενώσεις του μη μετάλλου με ένα μη μέταλλο είναι ομοιοπολικές.
- Οι ιοντικές ενώσεις έχουν ιόντα σε διάλυμα ή σε τετηγμένη κατάσταση και αγώγουν ηλεκτρισμό
- Οι ιοντικοί δεσμοί είναι πολύ ισχυρότεροι από τους ομοιοπολικούς δεσμούς
- Οι ιοντικές ενώσεις τείνουν να είναι ένα στερεό με καθορισμένο σχήμα σε θερμοκρασία δωματίου, οι ομοιοπολικές ενώσεις είναι συνήθως αέρια, υγρά ή μαλακά στερεά
- Οι ιοντικές ενώσεις συχνά δεν διαλύονται σε οργανικούς διαλύτες, ενώ οι ομοιοπολικές ενώσεις συχνά διαλύονται
Ελπίζουμε ότι αυτό σας δίνει μια καλύτερη αίσθηση του ιοντικού έναντι του ομοιοπολικού.
Παραδείγματα ενώσεων με ιονικούς δεσμούς
Ακολουθούν ορισμένα παραδείγματα ιοντικών δεσμών:
- Χλωριούχο νάτριο, NaCl
- Θειικό μαγνήσιο, MgSO4
- Φθοριούχο καίσιο, CeF
- Υδροξείδιο του στροντίου, Sr(OH)2
- Κυανιούχο κάλιο, KCN
Παραδείγματα ενώσεων με ομοιοπολικούς δεσμούς
Ακολουθούν ορισμένα παραδείγματα ομοιοπολικού δεσμού:
- Νερό, H2 O
- Μεθάνιο, CH4
- Αμμωνία, NH3
- Ιωδιούχος κασσίτερος (IV), SnI4
- Χλωριούχο τιτάνιο (IV), TiCl4
Μάθετε περισσότερα στον Διαδραστικό μας περιοδικό πίνακα
Μόλις παρουσιάσαμε τον καλύτερο διαδραστικό περιοδικό πίνακα στον γαλαξία, όπου μπορείτε να εξερευνήσετε ιδιότητες των στοιχείων, τάσεις, ηλεκτραρνητικότητα, ημερομηνίες ανακάλυψης, ιόντα και πολλά άλλα.
Ionic vs Covalent – Περαιτέρω ανάγνωση
Ονομασία ομοιοπολικών ενώσεων
Ονομασία ιοντικών ενώσεων
Πολικοί εναντίον μη πολικοί δεσμοί
Πολικοί-Ομοιοπολικοί Δεσμοί




