Νόμοι αερίων:Νόμος του Μπόιλ
Βασικές έννοιες του νόμου του Boyle
Σε αυτό το σεμινάριο, θα μάθετε για τον τύπο του νόμου του Boyle και πώς αυτή η εξίσωση μπορεί να χρησιμοποιηθεί για τον προσδιορισμό των σχέσεων μεταξύ των αλλαγών στην πίεση και των αλλαγών στον όγκο σε ένα δεδομένο κλειστό σύστημα.
Ο Ρόμπερτ Μπόιλ, που μερικές φορές αποκαλείται «Πατέρας της Σύγχρονης Χημείας» εργάστηκε στους τομείς της φυσικής και της χημείας. Το 1660, ο Boyle δημοσίευσε το The Spring and Weight of the Air στα οποία περιέγραψε διάφορα πειράματα που δημιούργησε χρησιμοποιώντας μια αντλία κενού την οποία σχεδίασε.
Το 1662, ο Boyle δημοσίευσε την δεύτερη έκδοση του The Spring and Weight of the Air . Αυτό περιέγραψε την αντίστροφη σχέση μεταξύ πίεσης και όγκου, γνωστή πλέον ως Νόμος του Μπόιλ. Ο νόμος του Boyle δηλώνει ότι η πίεση και ο όγκος είναι αντιστρόφως ανάλογα μεταξύ τους. Καθώς η πίεση αυξάνεται, ο όγκος μειώνεται και όσο μειώνεται η πίεση αυξάνεται ο όγκος. Έκανε αυτές τις παρατηρήσεις χρησιμοποιώντας υδράργυρο σε ένα σωλήνα J και στη συνέχεια έκανε μετρήσεις του όγκου του αερίου σε πιέσεις χαμηλότερες και υψηλότερες από την τυπική ατμοσφαιρική πίεση.
Ο Μπόιλ εξέφρασε τα αποτελέσματά του σε μια σχέση που είναι γνωστή ως εξίσωση του νόμου του Μπόιλ ή ο τύπος του νόμου του Boyle:P1 V1 =P2 V2 . Αυτός ο νόμος προϋποθέτει ότι η θερμοκρασία παραμένει σταθερή.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι η πίεση
- Νόμος μερικής πίεσης του Ντάλτον
- Νόμος του Καρόλου
- Νόμος του Avogadro
- Ο νόμος του ιδανικού αερίου
- Η εξίσωση κατάστασης του Van der Waal
- Νόμος του Gay Lussac
- Συνδυασμένος νόμος για τα αέρια
- Νόμος του Χένρι
Σημαντικά πράγματα που πρέπει να λάβετε υπόψη
Ο νόμος για τα αέρια που περιγράφεται σε αυτό το άρθρο ισχύει μόνο για τα ιδανικά αέρια, για τα οποία μπορείτε να διαβάσετε στο άρθρο μας, Ο νόμος του ιδανικού αερίου .
Σχέση μεταξύ πίεσης και όγκου
Εξετάστε ένα δείγμα αερίου σε δοχείο 1 λίτρου. Από το άρθρο μας, Τι είναι η πίεση , γνωρίζουμε ότι η πίεση που ασκείται στο δοχείο από το αέριο είναι το άθροισμα των συγκρούσεων των σωματιδίων, διαιρούμενο με την επιφάνεια του δοχείου, 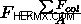 . Γνωρίζουμε επίσης ότι ο όγκος σχετίζεται με το εμβαδόν της επιφάνειας και εάν ο όγκος μειωθεί, θα μειωθεί και το εμβαδόν της επιφάνειας.
. Γνωρίζουμε επίσης ότι ο όγκος σχετίζεται με το εμβαδόν της επιφάνειας και εάν ο όγκος μειωθεί, θα μειωθεί και το εμβαδόν της επιφάνειας.
Από αυτές τις δύο σχέσεις, μπορούμε να δούμε ότι όσο μειώνεται ο όγκος, η συνολική πίεση θα αυξάνεται. Αυτό μας οδηγεί στον τύπο του νόμου του Boyle, 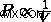 .
.
Μπορούμε να κάνουμε ένα γράφημα αυτής της σχέσης ως εξής:
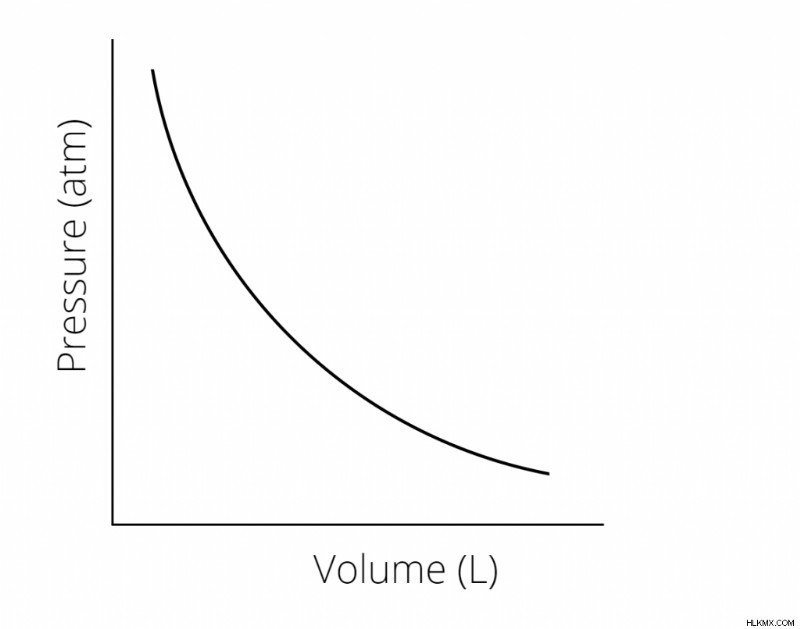
Αλλαγή πίεσης και όγκου
Αυτή η αναλογικότητα μπορεί να μας επιτρέψει να επιλύσουμε συγκεκριμένα προβλήματα που σχετίζονται με τις αλλαγές στην πίεση και τον όγκο σε ένα κλειστό σύστημα.
Σκεφτείτε, για παράδειγμα, ένα έμβολο γεμάτο οξυγόνο. Από αυτή την αναλογικότητα, γνωρίζουμε ότι εάν το έμβολο συμπιεστεί, η πίεση του αερίου θα αυξηθεί.
Εξίσωση του νόμου του Boyle – Παράδειγμα προβλήματος
Ακολουθεί ένα παράδειγμα για το πώς μπορείτε να λύσετε ένα πρόβλημα του νόμου του Boyle.
Ένα ιδανικό αέριο ασκεί πίεση 3 atm σε δοχείο 2 L. Ποια θα είναι η πίεση εάν ο όγκος του δοχείου αλλάξει σε 1 L σε σταθερή θερμοκρασία;
Λύση:
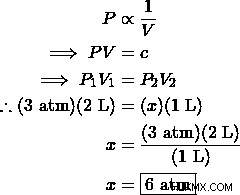
Μπορείτε να διαβάσετε πώς ένας μαθητής χρησιμοποίησε τα αρχικά δεδομένα του Boyle για να επαληθεύσει τον νόμο του Boyle.