Ιδιότητες Οξέων και Βάσεων
Βασικές έννοιες
Τι είναι ένα οξύ; Σε αυτό το σεμινάριο, θα μάθετε για τις διακριτικές ιδιότητες μεταξύ οξέων και βάσεων, τι ορίζει ένα οξύ έναντι της βάσης και επίσης τι είναι μια αμφοτερική ένωση. Εάν σας αρέσει αυτό το άρθρο, βεβαιωθείτε ότι έχετε διαβάσει τους άλλους οδηγούς οξέος-βάσης που αναφέρονται παρακάτω.
Σχετικά άρθρα
- Ισχυρά οξέα και βάσεις
- Τι είναι το pH;
- Χημεία οξέος-βάσης
- Θεωρίες οξέων βάσεων
Τι είναι τα οξέα και οι βάσεις;
Υπάρχουν επί του παρόντος τρεις ορισμοί για τα οξέα και τις βάσεις που συνεπάγονται πώς συμπεριφέρονται όταν τοποθετούνται σε διαλύματα. Αυτοί είναι οι ορισμοί Lewis, Bronsted-lowry και Arrhenius. Λοιπόν τι είναι οξύ ? Ουσιαστικά, τα οξέα δέχονται ζεύγη ηλεκτρονίων και δίνουν πρωτόνια υδρογόνου. Αντίθετα, οι βάσεις δίνουν ηλεκτρόνια και δέχονται πρωτόνια υδρογόνου. Εκτός από αυτούς τους ορισμούς, τα οξέα και οι βάσεις μπορούν να ταξινομηθούν με βάση τις ιδιότητές τους. Αυτές οι ιδιότητες περιλαμβάνουν το pH, τη γεύση, την υφή, την αντιδραστικότητα και την αγωγιμότητα.
Το όνομα «οξύ» προέρχεται από το λατινικό acidus , που σημαίνει «ξινό» και αναφέρεται στην ξινή γεύση και την έντονη μυρωδιά πολλών οξέων.
pH οξέων και βάσεων
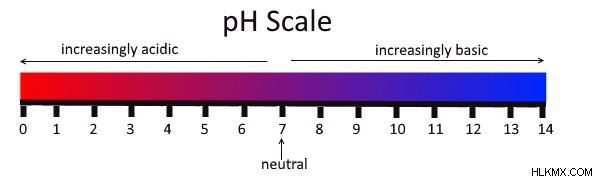
Η κλίμακα pH είναι ένα μέτρο του πόσο όξινο ή βασικό είναι ένα διάλυμα και κυμαίνεται από 0 έως 14. Όπως μπορείτε να δείτε στην παραπάνω εικόνα, τα όξινα διαλύματα έχουν pH μικρότερο από 7, ενώ οι βάσεις έχουν pH υψηλότερο από 7. Διαλύματα με pH 7, όπως το νερό (H2 O), θεωρούνται ουδέτερα . Υπάρχουν πολλοί διαφορετικοί τρόποι μέτρησης του pH ενός διαλύματος, αλλά δύο κοινές μέθοδοι είναι η χρήση δεικτών και ανιχνευτών. Οι ανιχνευτές τείνουν να είναι πιο ακριβείς επειδή η συσκευή τοποθετείται στο διάλυμα και διαβάζεται ψηφιακά. Εν τω μεταξύ, με τους δείκτες, πρέπει να χρησιμοποιήσετε τα μάτια σας για να παρατηρήσετε οποιαδήποτε αλλαγή χρώματος και να τη συγκρίνετε με την κλίμακα pH. Ένας τύπος δείκτη είναι το χαρτί λακκούβας. Τα οξέα θα γίνουν μπλε κόκκινο χαρτί λακκούβας και οι βάσεις θα γίνουν κόκκινο μπλε χαρτί λακκούβας. Παρατηρήστε πώς αυτό συσχετίζεται με τα χρώματα στην παραπάνω εικόνα.
Λοιπόν, τι σημαίνει για ένα διάλυμα να είναι όξινο ή βασικό; Τα όξινα διαλύματα έχουν υψηλή συγκέντρωση πρωτονίων υδρογόνου, ενώ τα βασικά διαλύματα έχουν υψηλή συγκέντρωση ιόντων υδροξειδίου. Όταν αυτές οι δύο λύσεις συνδυάζονται, αλληλοεξουδετερώνονται σε αυτό που ονομάζεται αντίδραση εξουδετέρωσης . Σε αυτήν την αντίδραση, τα προϊόντα είναι άλατα και νερό – το οποίο σχηματίζεται όταν τα πρωτόνια υδρογόνου και τα ιόντα υδροξειδίου συνδυάζονται.
Γεύση και υφή οξέων και βάσεων


Ένα άλλο καθοριστικό χαρακτηριστικό μεταξύ οξέων και βάσεων είναι η γεύση και η υφή. Πρέπει να σημειωθεί ότι θα πρέπει πάντα να ακολουθείτε τις οδηγίες ασφάλειας του εργαστηρίου και ποτέ μην καταναλώνετε ή αγγίζετε απευθείας χημικά . Πριν τεθούν σε πέτρα αυτοί οι κανονισμοί για να μας προστατεύσουν, οι χημικοί συνήθιζαν να δοκιμάζουν τα χημικά. Στην πραγματικότητα, ο διάσημος φυσικός και μαθηματικός Sir Isaac Newton δοκίμασε πάνω από εκατό διαφορετικές χημικές ουσίες όταν εξασκούσε την αλχημεία. Μεταξύ αυτών ήταν και το στοιχείο υδράργυρος – το οποίο είναι εξαιρετικά τοξικό και έχει αποδοθεί στον θάνατό του. Όπως αναφέρθηκε προηγουμένως, τα όξινα διαλύματα έχουν υψηλή συγκέντρωση ιόντων υδρογόνου. Αυτό κάνει τα οξέα να έχουν ξινή ή ξινή γεύση. Αν και δεν πρέπει ποτέ να καταναλώνετε οξέα στο εργαστήριο, μπορείτε να το συσχετίσετε με τη γεύση ενός λεμονιού. Τα λεμόνια είναι όξινα καθώς περιέχουν υψηλές ποσότητες κιτρικού οξέος. Επιπλέον, τα λεμόνια έχουν pH περίπου 2-3 που εμπίπτει στην όξινη κατηγορία σε κλίμακα pH. Όσο για τις βάσεις, τείνουν να έχουν πικρή γεύση. Ένα παράδειγμα αυτού θα ήταν αν έχετε δοκιμάσει ποτέ μια φούσκα σαπουνιού.
Και πάλι, δεν πρέπει ποτέ να αγγίζετε εσκεμμένα χημικά στο δέρμα σας, καθώς μπορεί να είναι επιβλαβή και λειαντικά. Ωστόσο, εάν συνέβαινε σε ένα εργαστήριο, θα μπορούσατε να προσδιορίσετε εάν είναι οξύ ή βάση με βάση την αφή. Εάν το διάλυμα αισθάνεται σαν σαπούνι ή γλιστερό, είναι μια βάση. Αυτό συμβαίνει γιατί οι βάσεις διαλύουν τα έλαια λιπαρών οξέων από το δέρμα μας και ουσιαστικά μετατρέπουν το δέρμα μας σε σαπούνι. Εν τω μεταξύ, τα οξέα είναι συνήθως τραχιά στην αφή.
Δραστικότητα οξέων και βάσεων
Αντιδράσεις με μέταλλα
Όταν τα οξέα αντιδρούν με μέταλλα, το αποτέλεσμα είναι πολύ παρόμοιο με μια αντίδραση εξουδετέρωσης. Η μόνη διαφορά είναι ότι αντί να παράγετε νερό, θα πάρετε αέριο υδρογόνο. Ανεξάρτητα από το οξύ ή το μέταλλο που χρησιμοποιείται, θα πάντα παράγουν αλάτι και H2 αέριο. Ένα παράδειγμα αυτού είναι η αντίδραση μεταξύ μαγνησίου και υδροχλωρικού οξέος. Όταν συνδυάζονται, τα προκύπτοντα προϊόντα είναι χλωριούχο μαγνήσιο και αέριο υδρογόνο. Όσο για τις βάσεις, συνήθως δεν αντιδρούν με μέταλλα, αλλά υπάρχουν μερικά μέταλλα που κάνουν εξαιρέσεις όπως ο ψευδάργυρος και το αλουμίνιο. Αυτές οι αντιδράσεις έχουν επίσης ως αποτέλεσμα άλατα και αέριο υδρογόνο.
Αντιδράσεις με ανθρακικά
Τα οξέα μπορούν επίσης να αντιδράσουν με ανθρακικά, οπότε παράγουν αλάτι, νερό και διοξείδιο του άνθρακα. Τα ανθρακικά άλατα σχηματίζονται όταν συνδυάζονται με μέταλλα ή οργανικές ενώσεις. Το μοναδικό χαρακτηριστικό εδώ είναι η παραγωγή διοξειδίου του άνθρακα. Αυτό μπορεί να χειριστεί στο εργαστήριο για να προσδιοριστεί εάν ένα άγνωστο διάλυμα είναι βασικό ή όξινο. Απλώς προσθέστε το ανθρακικό διάλυμα και εάν παράγεται διοξείδιο του άνθρακα, το διάλυμα είναι πιθανόν όξινο.
Αντιδράσεις με λίπη/έλαια
Νωρίτερα στο άρθρο αναφέρθηκε ότι οι βάσεις διαλύουν τα έλαια στο δέρμα μας και ουσιαστικά μετατρέπουν το δέρμα μας σε σαπούνι. Αυτή η διαδικασία διάλυσης των λιπών και των ελαίων ονομάζεται υδρόλυση και όταν υπάρχει μια βάση, είναι γνωστή ως σαπωνοποίηση. Ουσιαστικά αυτή η αντίδραση σημαίνει ότι οι βάσεις συνδυάζονται με λίπη για να σχηματίσουν γλυκερίνη ή σαπούνι.
Αγωγιμότητα οξέων και βάσεων
Σε όλο αυτό το άρθρο, έχουμε μιλήσει για το πώς τα οξέα και οι βάσεις μπορούν να ιονιστούν σε πρωτόνια υδρογόνου και ιόντα υδροξειδίου όταν τοποθετηθούν σε ένα διάλυμα. Ηλεκτρολύτες είναι άλατα/μόρια που ιονίζονται πλήρως σε πολικές ουσίες όπως το νερό. Για το λόγο αυτό, ισχυρά οξέα και βάσεις είναι επίσης ισχυροί ηλεκτρολύτες. Αυτοί οι ηλεκτρολύτες είναι ικανοί να μεταφέρουν ηλεκτρισμό στην υδατική τους κατάσταση επειδή τα ιόντα τους είναι κινητά.
Συνοπτικό Σύγκριτο Διάγραμμα
| Ιδιότητες | Οξέα | Βάσεις |
| Γεύση | τάρτα/ ξινή | πικρή |
| Υφή | Ακατέργαστο | Σαπούνι και γλιστερό |
| pH | Λιγότερο από 7 | Περισσότερο από 7 |
| Γυρίζει το χαρτί λακκούβας.. | Μπλε—->Κόκκινο | Κόκκινο—->Μπλε |
| Αντιδραστικότητα | – Αντιδρά με μέταλλα για την παραγωγή αερίου Η2 – Αντιδρά με ανθρακούχες ενώσεις για την παραγωγή CO2 | – Συνήθως δεν αντιδρά με μέταλλα ή με ανθρακούχες ενώσεις – Αντιδρά με έλαια και λίπη |
| Μεταφέρει ηλεκτρισμό στο νερό | ναι | ναι |
| Παραδείγματα | ξύδι (αιθανοϊκό οξύ) , χυμός λεμονιού (κιτρικό οξύ) | Μαγειρική σόδα (όξινο ανθρακικό νάτριο), νερό αμμωνίας (υδροξείδιο αμμωνίας) |
Τι είναι μια Αμφοτερική Ένωση;
Εάν μια ένωση είναι αμφοτερική, μπορεί να αντιδράσει είτε ως οξύ είτε ως βάση. Οι αμφοτερικές ενώσεις είναι συνήθως οξείδια ή υδροξείδια μετάλλων. Αντιδρούν με οξέα για να σχηματίσουν ένα μεταλλικό άλας και με μια ισχυρή βάση για να σχηματίσουν ένα πολυατομικό μεταλλικό ιόν. Για να αντιδράσει με μια βάση, το αμφοτερικό υδροξείδιο χρειάζεται συχνά να έχει παραχθεί πρόσφατα και η βάση πρέπει να είναι ζεστή και συμπυκνωμένη. Στο ακόλουθο παράδειγμα, το οξείδιο του ψευδαργύρου γίνεται το ιόν ψευδαργύρου Zn(OH)4 ως μέρος του διαλυτού ψευδαργύρου νατρίου, όταν προστίθεται σε συμπυκνωμένη βάση.
- Σε οξύ:ZnO + H2 SO4 → ZnSO4 + H2 O
- Σε βάση:ZnO + 2 NaOH + H2 O → Na2 [Zn(OH)4 ]
Παραδείγματα αμφοτερικών ενώσεων
Υδροξείδιο χρωμίου, υδροξείδιο κασσίτερου, υδροξείδιο μολύβδου, υδροξείδιο κοβαλτίου, υδροξείδιο ψευδαργύρου, οξείδιο ψευδαργύρου, υδροξείδιο αλουμινίου και οξείδιο αλουμινίου.
Τι είναι το πολυπρωτικό οξύ;
Ορισμένα οξέα έχουν περισσότερα από ένα όξινα πρωτόνια, όπως το θειικό οξύ ή το φωσφορικό οξύ. Αυτές οι ενώσεις έχουν πολλές ενδιαφέρουσες ιδιότητες και χρήσεις. Για περισσότερες πληροφορίες, ανατρέξτε στον οδηγό μας για τα πολυπρωτικά οξέα.
Βίντεο που δείχνει τις ιδιότητες ενός οξέος
Περαιτέρω ανάγνωση
- Τι είναι το pKa;
- Ποσοτικοποίηση πρωτονίων Νετρονίων και ηλεκτρονίων
- Υπολογισμός μοριακής μάζας




