Εξίσωση Arrhenius
Εξίσωση Arrhenius- Core Concept
Σε αυτό το σεμινάριο, θα μάθετε τι είναι η εξίσωση Arrhenius, πώς να χρησιμοποιήσετε την εξίσωση για να προσδιορίσετε την ενέργεια ενεργοποίησης ή τη σταθερά ταχύτητας μιας αντίδρασης και πώς να την εξάγετε. Η χρήση της εξίσωσης Arrhenius είναι μια σημαντική έννοια στη χημική κινητική.
Τι είναι η εξίσωση Arrhenius;
Η εξίσωση Arrhenius χρησιμοποιείται για τον προσδιορισμό της ενέργειας ενεργοποίησης ή της σταθεράς ταχύτητας μιας χημικής αντίδρασης. καθώς η θερμοκρασία αλλάζει. Αν θέλετε να δείτε πώς αλλάζει η σταθερά ρυθμού όταν αλλάζει η θερμοκρασία, η εξίσωση Arrhenius είναι φίλος σας.
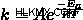
Οπου 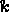 είναι σταθερά ταχύτητας,
είναι σταθερά ταχύτητας, 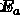 είναι η ενέργεια ενεργοποίησης (η ενέργεια που απαιτείται για να ξεκινήσει η αντίδραση),
είναι η ενέργεια ενεργοποίησης (η ενέργεια που απαιτείται για να ξεκινήσει η αντίδραση), 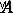 είναι ο παράγοντας συχνότητας,
είναι ο παράγοντας συχνότητας, 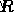 είναι η σταθερά αερίου και
είναι η σταθερά αερίου και 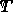 είναι η θερμοκρασία.
είναι η θερμοκρασία.
Παραγωγή της εξίσωσης Arrhenius
Η εξίσωση Arrhenius μπορεί να προκύψει από πειραματικά δεδομένα. Όταν γραμμικοποιούμε την εξίσωση στη μορφή y=mx+b, παίρνουμε
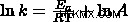
Τώρα θέλουμε να λύσουμε 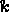
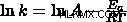
Σηκώστε και τις δύο πλευρές στο e για να απαλλαγείτε από το φυσικό κούτσουρο
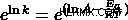
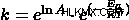
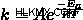
Όταν μας δίνονται δύο είσοδοι θερμοκρασίας, μπορούμε να χρησιμοποιήσουμε διαφορετική μορφή της εξίσωσης.
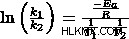
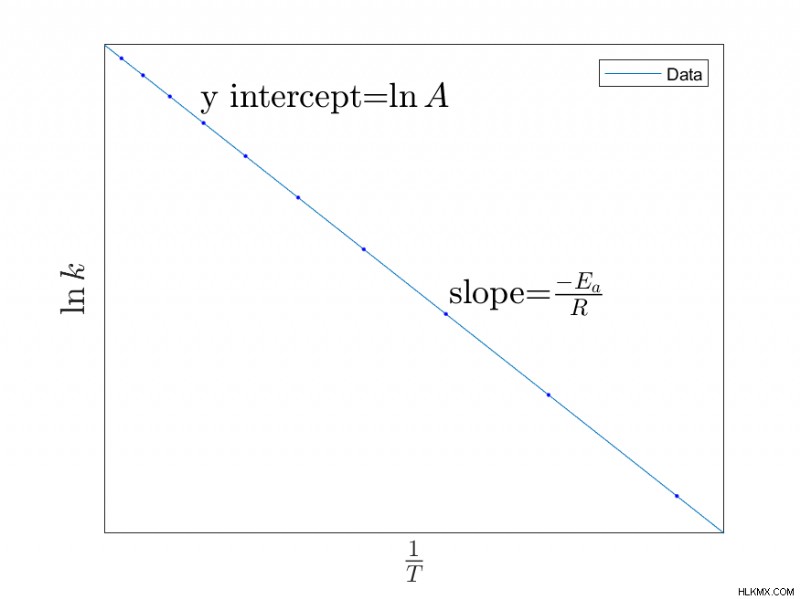
Οπτικοποίηση της εξίσωσης Arrhenius
Σχεδιάζοντας την προηγούμενη εξίσωση, μπορούμε να βρούμε χαρακτηριστικά μιας αντίδρασης. Για παράδειγμα, γραφική παράσταση της γραμμικοποιημένης συνάρτησης με σχεδίαση 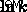 vs.
vs. 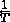 , μπορείτε να καθορίσετε την κλίση που θα
, μπορείτε να καθορίσετε την κλίση που θα 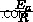 και η σταθερά Arrhenius
και η σταθερά Arrhenius 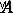 , η οποία θα είναι η τομή y.
, η οποία θα είναι η τομή y.
Παράδειγμα προβλημάτων της εξίσωσης Arrhenius:
Η σταθερά ταχύτητας k μιας χημικής αντίδρασης μετριέται σε δύο διαφορετικές θερμοκρασίες:
k1 =1,2 x 10 στους 425 βαθμούς Κελσίου
k2 =1,4 x 10 στους 538 βαθμούς Κελσίου
Υπολογίστε την ενέργεια ενεργοποίησης αυτής της χημικής αντίδρασης.
Λύση:
Εφόσον μας δίνονται δύο είσοδοι θερμοκρασίας, πρέπει να χρησιμοποιήσουμε τη δεύτερη μορφή της εξίσωσης:
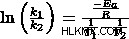
Αρχικά, μετατρέπουμε τις θερμοκρασίες Κελσίου σε Kelvin προσθέτοντας 273,15:
425 βαθμοί Κελσίου =698,15 K
538 βαθμοί Κελσίου =811,15 Κ
Τώρα ας συνδέσουμε όλες τις τιμές. Γνωρίζουμε ότι k1 =1,2 x 10 και k2 =1,4 x 10 και τώρα έχουμε τις τιμές T.
ln((1,2 x 10)/(1,4 x 10))=(-Ea /(8,31 J/Kmol))((1/698,15 K)-(1/811,15 K))
-Ea =-6735
Ea =6735 J/mol
Παράδειγμα προβλήματος 2:
Η αντίδραση αποσύνθεσης 2NO2(g) —–> 2ΟΧΙ(g) + O2(g) έχει Ea 1,14 x 10 J/mol και σταθερά ρυθμού 7,02 x 10 L/mol x s στα 500 K. Σε ποια θερμοκρασία ο ρυθμός θα είναι διπλάσιος
Εάν σας ζητηθεί να λύσετε μια διαφορετική μεταβλητή, υπάρχουν μερικοί τρόποι για να ελέγξετε την εργασία σας. Η μεγαλύτερη σταθερά ρυθμού k πρέπει πάντα να σχετίζεται με την υψηλότερη θερμοκρασία. Η ενέργεια ενεργοποίησης πρέπει να έχει πάντα θετικό πρόσημο. Ο ρυθμός αντίδρασης και η σταθερά ταχύτητας είναι και οι δύο μεγαλύτερες σε υψηλότερες θερμοκρασίες, εφόσον όλοι οι άλλοι παράγοντες παραμένουν σταθεροί.
Λύση
Εάν ο ρυθμός αντίδρασης είναι διπλάσιος, k2 =2k1 =(7,02 x 10 L/mol x s) x 2 =1,40 x 10 L/mol x s
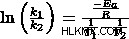
ln((1,40 x 10 L/mol x s)/(7,02 x 10 L/mol x s))=((1,14 x 10 J/mol)/8,314 J/mol x K) x ((1/500K)-(1 /T2 )
0,69029=13712 K x (0,00200 K-1/T2 )
0,00195 x 10 K =1/T2
T2 =513 K
Διασκεδαστικά γεγονότα/ Πρόσθετες πληροφορίες
- Ένα γράφημα δεδομένων που χρησιμοποιείται για τη δημιουργία της εξίσωσης Arrhenius ονομάζεται διάγραμμα Arrhenius, όπου ο άξονας X είναι 1/T και ο άξονας Y είναι το φυσικό log του k. Η κλίση είναι -Ea /R.
- Η εξίσωση πήρε το όνομά της από τον Σουηδό χημικό Svante Arrhenius ο οποίος ανακάλυψε τη σχέση μεταξύ των ρυθμών αντίδρασης και της θερμοκρασίας το 1889.
Αναφορές:
Silberberg και Amateis. Χημεία:Η μοριακή φύση της ύλης και της αλλαγής . 8η Έκδοση, McGraw-Hill, 2018.




