VSEPR Θεωρία &Διάγραμμα
Τι είναι η θεωρία VSEPR;
Η θεωρία VSEPR είναι συντομογραφία του Valence Shell Electron Pair Repulsion Theory, μια μέθοδος οργάνωσης μορίων με βάση τις γεωμετρικές δομές τους. Στη χημεία, η θεωρία VSEPR βασίζεται στην αρχή ότι κάθε άτομο σε ένα μόριο θα αναζητήσει μια γεωμετρία που μεγιστοποιεί την απόσταση μεταξύ των ζευγών ηλεκτρονίων σθένους, ελαχιστοποιώντας έτσι την απώθηση ηλεκτρονίου-ηλεκτρονίου. Τα ηλεκτρόνια σθένους απωθούν το ένα το άλλο επειδή είναι αρνητικά φορτισμένα και παρόμοια φορτία απωθούνται.
VSEPR Θεωρία μορίων χωρίς μεμονωμένα ζεύγη ηλεκτρονίων στο κεντρικό άτομο
Για απλότητα και οργάνωση, θα διαχωρίσουμε τις δομές VSEPR σε δύο κατηγορίες:αυτές με μεμονωμένα ζεύγη στο κεντρικό άτομο και εκείνες χωρίς μεμονωμένα ζεύγη στο κεντρικό άτομο.
Γραμμικό
BeF2 είναι ένα παράδειγμα γραμμικού μορίου. Υπάρχουν 16 συνολικά ηλεκτρόνια σθένους σε ένα BeF2 μόριο, με τρία μόνα ζεύγη (έξι ηλεκτρόνια) σε κάθε άτομο φθορίου. Προκειμένου αυτά τα μεμονωμένα ζεύγη σε κάθε αντίστοιχο άτομο φθορίου να είναι η μεγαλύτερη δυνατή απόσταση από το άλλο άτομο φθορίου, το μόριο σχηματίζει μια ευθεία γραμμή. Αναφερόμαστε σε αυτό το σχήμα ως "Γραμμικό". Οι γωνίες δεσμού σε ένα γραμμικό μόριο είναι 180 μοίρες. CO2 και BeH2 είναι επίσης γραμμικά μόρια.
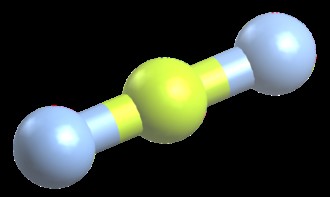
Τριγωνικό επίπεδο
BF3 είναι ένα παράδειγμα ενός τριγωνικού επίπεδου μορίου. Υπάρχουν 24 συνολικά ηλεκτρόνια σθένους σε ένα BF3 μόριο. Προκειμένου κάθε άτομο φθορίου να κρατά τα μόνα του ζεύγη όσο το δυνατόν πιο μακριά από τα άλλα άτομα φθορίου, το μόριο σχηματίζει ένα τριγωνικό, δισδιάστατο σχήμα. Στη μοριακή γεωμετρία, αυτό είναι γνωστό ως "τριγωνικό επίπεδο". Οι γωνίες δεσμού σε ένα τριγωνικό επίπεδο μόριο είναι 120 μοίρες. CO3 (ανθρακικό) είναι ένα άλλο παράδειγμα τριγωνικού επίπεδου μορίου.
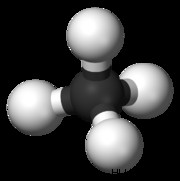
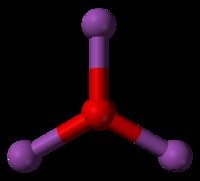
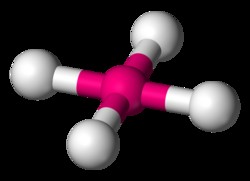
Τετραεδρικό
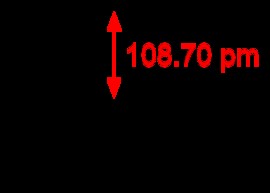
Ένα συνηθισμένο παράδειγμα τετραεδρικού μορίου είναι το CH4 (μεθάνιο). Υπάρχουν οκτώ συνολικά ηλεκτρόνια σθένους σε ένα μόριο μεθανίου. Προκειμένου τα τέσσερα υδρογόνα να είναι πιο μακριά το ένα από το άλλο, φτάνουμε σε ένα τετραεδρικό σχήμα. Τετραεδρικό είναι η τρισδιάστατη έκφραση της τετράγωνης επίπεδης γεωμετρίας. Η γωνία δεσμού H-C-H σε ένα τετραεδρικό μόριο είναι 109,5 μοίρες.
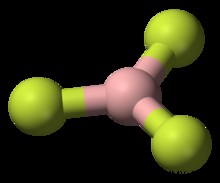
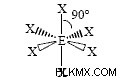
Trigonal Bipyramidal
PF5 είναι ένα παράδειγμα ενός Τριγωνικού Διπυραμιδικού μορίου. PF5 έχει 38 συνολικά ηλεκτρόνια σθένους. Κάθε δεσμός P-F χρησιμοποιεί 2 ηλεκτρόνια σθένους και κάθε άτομο φθορίου έχει τρία μονά ζεύγη. Ο φώσφορος μπορεί να επεκτείνει την οκτάδα του. Τρία από τα άτομα φθορίου βρίσκονται σε αυτό που ονομάζεται ισημερινή θέση. Τα άλλα δύο βρίσκονται σε αυτό που ονομάζεται αξονική θέση. Προκειμένου τα φθόριο του ισημερινού να είναι όσο το δυνατόν πιο μακριά το ένα από το άλλο, οι δεσμοί P-F βρίσκονται σε γωνία 120 μοιρών μεταξύ τους και οι γωνίες δεσμού μεταξύ της ισημερινής και της αξονικής θέσης είναι 90 μοίρες.
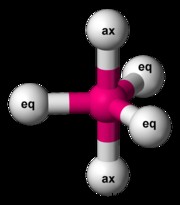
Οκτάεδρος
SF6 είναι ένα παράδειγμα οκταεδρικού μορίου. Υπάρχουν 48 ηλεκτρόνια σθένους σε ένα SF6 μόριο. Κάθε δεσμός S-F αντιπροσωπεύει δύο ηλεκτρόνια σθένους και κάθε άτομο φθορίου φέρει τρία μόνα ζεύγη. Το θείο μπορεί να επεκτείνει την οκτάδα του. Η απώθηση μεταξύ των ατόμων φθορίου μπορεί να ελαχιστοποιηθεί τοποθετώντας το καθένα στη γωνία ενός οκταέδρου.
VSEPR Θεωρία μορίων με μεμονωμένα ζεύγη ηλεκτρονίων στο κεντρικό άτομο
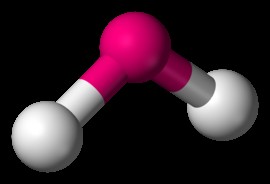
Λυγισμένη
H2 Το O είναι ένα παράδειγμα λυγισμένου μορίου. Όταν το κεντρικό άτομο σε ένα μόριο έχει μεμονωμένα ζεύγη, αυτά τα μόνα ζεύγη απωθούν τους δεσμούς που έχουν τις ρίζες τους στο κεντρικό άτομο. Σε ένα μόριο νερού, τα μόνα ζεύγη στο άτομο οξυγόνου αναγκάζουν τους δεσμούς υδρογόνου προς τα κάτω σε δισδιάστατο χώρο. Η γωνία δεσμού μεταξύ των ατόμων υδρογόνου είναι 104 μοίρες.
Τριγωνικό πυραμιδικό
NH3 είναι ένα παράδειγμα ενός τριγωνικού πυραμιδικού μορίου. Στο μόριο αμμωνίας, το μοναχικό ζεύγος στο κεντρικό άτομο αζώτου ωθεί τους τρεις δεσμούς N-H προς τα κάτω λόγω της απώθησης ηλεκτρονίου-ηλεκτρονίου.
Τραμπάλα
SF4 είναι ένα παράδειγμα μορίου με σχήμα τραμπάλας. Σε ένα SF4 μόριο, δύο από τους δεσμούς S-F βρίσκονται ο ένας απέναντι στον άλλο στο ισημερινό επίπεδο. Οι άλλοι δύο δεσμοί S-F απομακρύνονται ο ένας από τον άλλο σε τρισδιάστατο χώρο. Αυτό επιτρέπει στα άτομα φθορίου να είναι η μεγαλύτερη απόσταση μεταξύ τους, λαμβάνοντας υπόψη ότι υπάρχει ένα μοναχικό ζεύγος ηλεκτρονίων στο κεντρικό άτομο θείου. Αυτό το μοναχικό ζεύγος σπρώχνει τους δεσμούς S-F μακριά, όπως συμβαίνει σε λυγισμένες ή τριγωνικές πυραμιδικές γεωμετρίες.
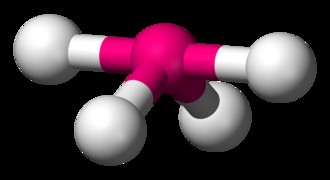
Σχήμα Τ
BrF3 είναι ένα παράδειγμα μορίου Σχήματος Τ. Σε ένα BrF3 μόριο, υπάρχουν δύο μόνα ζεύγη στο κεντρικό άτομο του βρωμίου, αναγκάζοντας πιο ακραία απώθηση ηλεκτρονίου-ηλεκτρονίου με τους δεσμούς Br-F από ό,τι σε άλλες γεωμετρίες. Αυτό το σχήμα προχωρά σε γωνίες δεσμού 86,2 μοιρών, κάτι που είναι μοναδικό για τα μόρια σχήματος Τ.
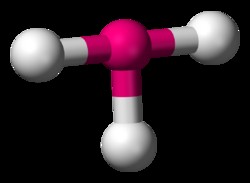
Τετράγωνο πυραμιδικό
Σε ένα BrF5 μόριο, η γεωμετρία μιμείται στενά την οκταεδρική γεωμετρία. Η μόνη διαφορά είναι ότι στην τετράγωνη πυραμιδική γεωμετρία, ένα από τα αξονικά άτομα αντικαθίσταται από ένα μοναχικό ζεύγος ηλεκτρονίων.
Τετράγωνο επίπεδο
Στο τετράγωνο επίπεδο μόριο XeF4 , η γεωμετρία μιμείται στενά αυτή της τετραγωνικής πυραμιδικής, αλλά για αυτό, ο αξονικός δεσμός έχει αντικατασταθεί με ένα άλλο μοναχικό ζεύγος ηλεκτρονίων. Αυτό ωθεί και τους τέσσερις δεσμούς Xe-F σε μια επίπεδη, ισημερινή διάταξη.
Μέθοδος AXE
Η μέθοδος AX είναι ένας εναλλακτικός τρόπος έκφρασης μοριακών γεωμετριών. Στο μοντέλο AX, το Α αντιπροσωπεύει το κεντρικό άτομο. Το X αντιπροσωπεύει το κεντρικό άτομο, το X αντιπροσωπεύει τον αριθμό των απλών δεσμών που συνδέονται με το κεντρικό άτομο και το E αντιπροσωπεύει τον αριθμό των μονών ζευγών ηλεκτρονίων που βρίσκονται στο κεντρικό άτομο.
| AX | Γραμμικό |
| AX3 | Τριγωνικό επίπεδο |
| AX2 E | Λυγισμένο |
| AX6 | Οκτάεδρος |
| AX5 | διπυραμιδικό |
| AX4 | Τετραεδρικό |
| AX3 E | Πυραμιδική |
| AX3 E2 | Τραμπάλα |
| AX3 E2 | Σχήμα Τ |
| AX5 E | Τετράγωνο πυραμιδικό |
| AX4 E2 | Τετράγωνο επίπεδο |
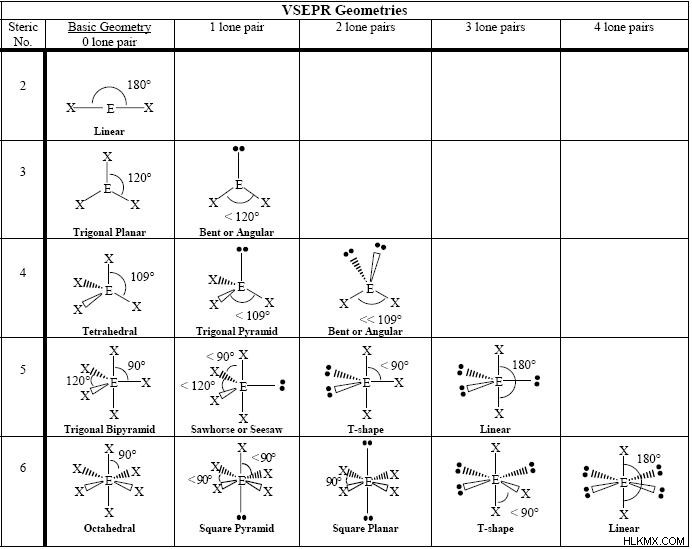
Διάγραμμα VSEPR &Στερικός αριθμός
Αυτό το διάγραμμα VSEPR σάς δείχνει όλες τις κοινές γεωμετρίες του VSEPR, οργανωμένες με βάση τον στερικό αριθμό και πόσα ζεύγη μονάδων ηλεκτρονίων έχουν. Ο στερικός αριθμός είναι πόσα άτομα συνδέονται με ένα κεντρικό άτομο ενός μορίου συν τον αριθμό των μεμονωμένων ζευγών ηλεκτρονίων που συνδέονται με αυτό το άτομο. Χρησιμοποιείται στη θεωρία απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους για την εύρεση της μοριακής γεωμετρίας.
Πραγματική εφαρμογή της θεωρίας VSEPR
Οι χημικές ιδιότητες ορισμένων μορίων συχνά αντικατοπτρίζουν τις γεωμετρικές δομές τους και το VSEPR είναι ο καλύτερος τρόπος για να διατυπώσετε έναν ενημερωμένο ισχυρισμό σχετικά με τη δομή ενός συγκεκριμένου μορίου.
Οι ιδιότητες που συχνά υποδηλώνονται με μοριακή δομή περιλαμβάνουν την πολικότητα, το χρώμα, τον διαμαγνητισμό/παραμαγνητισμό και τη βιολογική δραστηριότητα. Οι γεωμετρικές δομές δίνουν επίσης στους χημικούς και άλλους επιστήμονες έναν παραγωγικό τρόπο οργάνωσης των μορίων.
Περίληψη θεωρίας VSEPR
Η θεωρία απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους είναι μια μέθοδος πρόβλεψης της γεωμετρίας των μορίων. Βασίζεται στην βασική ιδέα ότι τα ηλεκτρόνια απωθούν το ένα το άλλο λόγω των παρόμοιων φορτίων τους, και τα μόρια κατασκευάζονται με τρόπο που θέτει τη μεγαλύτερη δυνατή απόσταση μεταξύ μοναχικών ζευγών ηλεκτρονίων. Τα περισσότερα στοιχειώδη μόρια μπορούν να χωρέσουν σε 11 διαφορετικές κατηγορίες σχημάτων και μπορούμε να τις προβλέψουμε με ακρίβεια απλά γνωρίζοντας τον αριθμό των ηλεκτρονίων σθένους, αναγνωρίζοντας το κεντρικό άτομο και χρησιμοποιώντας τη θεωρία VSEPR.




