London Dispersion και Van der Waals Forces
Van der Waals και London Dispersion Forces
Οι δυνάμεις Van der Waals είναι ένας τύπος διαμοριακής δύναμης που εμφανίζεται λόγω των αλληλεπιδράσεων διπόλου-διπόλου. Η δύναμη διασποράς του Λονδίνου είναι ένας υπο-τύπος της δύναμης Van der Waals που κυριαρχεί στα μη πολικά μόρια. Μια διαμοριακή δύναμη είναι μια δύναμη που εμφανίζεται μεταξύ δύο διαφορετικών μορίων.
Όλες αυτές οι δυνάμεις είναι πιο αδύναμες από τους ιοντικούς και τους ομοιοπολικούς δεσμούς. Δρουν επίσης σε μικρή απόσταση και είναι πιο αδύναμα όσο περισσότερα μόρια βρίσκονται μεταξύ τους.
Παρακάτω θα βουτήξουμε τόσο στις δυνάμεις Van der Waals γενικά όσο και στις δυνάμεις διασποράς του Λονδίνου.
Τι είναι οι δυνάμεις Van der Waals;
Οι δυνάμεις Van der Waals είναι ασθενείς δυνάμεις μεταξύ μορίων που εμφανίζονται είτε λόγω προσωρινών είτε μόνιμων διπόλων. Ονομάζονται επίσης δυνάμεις διασποράς. Τα δίπολα (είτε προσωρινά είτε μόνιμα) προκαλούν έλξη μεταξύ των μορίων.
Οι δυνάμεις Van der Waals περιλαμβάνουν δυνάμεις διασποράς του Λονδίνου (συζητούνται παρακάτω), δυνάμεις διπόλου-διπόλου και ιόντων-διπόλου. Η ισχυρότερη δύναμη από αυτά είναι το ιόν-δίπολο ακολουθούμενο από το δίπολο-δίπολο. Οι δυνάμεις διασποράς του Λονδίνου είναι η πιο αδύναμη δύναμη.
Όλα τα μόρια βιώνουν δυνάμεις διασποράς του Λονδίνου. Ωστόσο, είναι η μόνη διαμοριακή δύναμη (IMF) που υπάρχει σε μη πολικά μόρια. Στα πολικά μόρια, κυριαρχούν άλλα ΔΝΤ, επομένως, παρόλο που υπάρχουν δυνάμεις διασποράς του Λονδίνου, ενδέχεται να μην αναφέρονται.
Οι αλληλεπιδράσεις Van der Waals είναι ονόματα από τον Johannes Diderik van der Waals. Ο Van der Waals ήταν ο πρώτος που πρότεινε τις διαμοριακές δυνάμεις ως αιτία για τις ιδιότητες ορισμένων μορίων.
London Dispersion Force
Η δύναμη διασποράς του Λονδίνου εμφανίζεται μεταξύ δύο μορίων λόγω ενός προσωρινού διπόλου. Η δύναμη προκύπτει λόγω της ανομοιόμορφης κατανομής των ηλεκτρονίων που προκαλεί ένα προσωρινό δίπολο. Κατά μέσο όρο, τα ηλεκτρόνια είναι ομοιόμορφα κατανεμημένα, αλλά σε κάθε περίπτωση, μπορεί να συγκεντρωθούν στη μία πλευρά ενός μορίου. Αυτή η ομαδοποίηση προκαλεί ένα στιγμιαίο δίπολο. Το στιγμιαίο δίπολο μπορεί να προκαλέσει το σχηματισμό ενός προσωρινού διπόλου στα γύρω μόρια. Στη συνέχεια, τα δίπολα σε κάθε μόριο ασκούν δύναμη το ένα στο άλλο.
Αυτός είναι ο πιο αδύναμος τύπος διαμοριακής δύναμης.
Όσο μεγαλύτερο είναι το νέφος ηλεκτρονίων γύρω από ένα μόριο, τόσο ισχυρότερο είναι το στιγμιαίο δίπολο και, επομένως, η ελκτική δύναμη. Αυτό φαίνεται στην τάση για το σημείο τήξης και το σημείο βρασμού για τα αλογόνα.
| Αλογόνο | Σημείο τήξης (K) |
| F2 | 53.5 |
| Cl2 | 171.6 |
| Br2 | 265,9 |
| I2 | 386,8 |
Καθώς το μέγεθος του νέφους ηλεκτρονίων του μορίου αυξάνεται (μετακίνηση προς τα κάτω σειρές του περιοδικού πίνακα), το σημείο τήξης αυξάνεται. Το αυξημένο σημείο τήξης υποδεικνύει ισχυρότερες δυνάμεις που πρέπει να σπάσουν μεταξύ των μορίων.
Η έλξη θα είναι επίσης ισχυρότερη σε ένα μακρύτερο πιο απλωμένο μόριο από ένα συμπαγές μόριο. Το διασκορπισμένο μόριο έχει μεγαλύτερη ικανότητα πόλωσης και επαφή με τα γύρω μόρια.
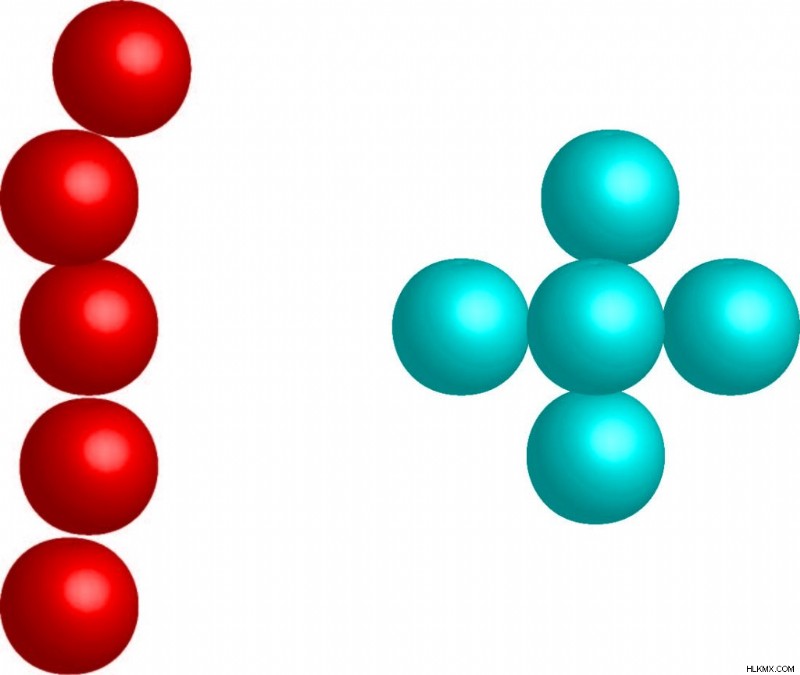
Το κόκκινο μόριο θα έχει ισχυρότερες δυνάμεις διασποράς του Λονδίνου λόγω του μήκους του σε σύγκριση με το συμπαγές μπλε μόριο με τον ίδιο αριθμό ατόμων. Το μεγαλύτερο μήκος σημαίνει ότι υπάρχει μεγαλύτερη απόσταση για να κινηθεί ένα ηλεκτρόνιο και να δημιουργήσει ένα ισχυρότερο δίπολο.
Γνωρίζουμε ότι αυτές οι δυνάμεις πρέπει να υπάρχουν επειδή υπάρχουν μη πολικά μόρια που είναι υγρά σε θερμοκρασία δωματίου. Εάν δεν υπάρχουν διαμοριακές δυνάμεις μεταξύ τους, θα ήταν αέρια.
Παράδειγμα προβλημάτων
Ποιο μόριο θα είχε μεγαλύτερες δυνάμεις του ΔΝΤ:Βρώμιο ή Φθόριο;
Η σωστή απάντηση είναι το βρώμιο. Και τα δύο μόρια είναι μη πολικά, επομένως το κύριο ΔΝΤ είναι οι δυνάμεις διασποράς του Λονδίνου. Το βρώμιο θα έχει μεγαλύτερη πολωσιμότητα λόγω του ότι έχει περισσότερα ηλεκτρόνια από το φθόριο.
Ποιο μόριο θα έχει μεγαλύτερες δυνάμεις διασποράς στο Λονδίνο:Μεθάνιο (CH4 ) ή εξάνιο (C6 H14 )?
Το εξάνιο είναι η σωστή απάντηση. Το εξάνιο θα έχει μεγαλύτερες δυνάμεις διασποράς του Λονδίνου επειδή το μόριο είναι μεγαλύτερο (από άποψη ατόμων) και πιο απλωμένο (μπορεί να γίνει πιο πολωμένο).
Εξίσωση Van der Waals
Η εξίσωση Van der Waals τροποποιεί τον νόμο των ιδανικών αερίων για να ληφθούν υπόψη οι ασθενείς διαμοριακές δυνάμεις. Οι διαμοριακές δυνάμεις διορθώνονται με την προσθήκη an/V στον όρο πίεσης. Ο άλλος διορθωτικός όρος είναι ο υπολογισμός του όγκου των μορίων
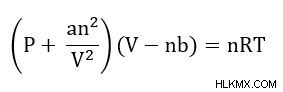
- P =Πίεση
- V =Τόμος
- n =Moles αερίου
- R=Ιδανική σταθερά αερίου
- T =Θερμοκρασία
- a =συντελεστής διόρθωσης σταθεράς αερίου (συγκεκριμένος για κάθε αέριο)
- b=συντελεστής διόρθωσης σταθεράς αερίου για το μέγεθος
Ιστορικό δυνάμεων διασποράς του Λονδίνου
Οι δυνάμεις διασποράς του Λονδίνου ονομάστηκαν από τον Γερμανό φυσικό Fritz London (1900-1954). Αν και είχε καταγωγή από τη Γερμανία, έφυγε το 1933 και πήγε στο Πανεπιστήμιο της Οξφόρδης. Στη συνέχεια, το 1939 αποδέχτηκε μια θέση στο Πανεπιστήμιο Duke. Εκεί συνέβαλε επίσης σε μεγάλο βαθμό στην ανάπτυξη της κβαντικής μηχανικής.




