s,p,d και f Στοιχεία μπλοκ
Ο περιοδικός πίνακας είναι μια συστηματική πίνακας διάταξης όλων των χημικών στοιχείων. Είναι μια γραφική αναπαράσταση του νόμου, που ισχυρίζεται ότι οι ιδιότητες των χημικών στοιχείων σχετίζονται με τους ατομικούς τους αριθμούς με προβλέψιμο τρόπο. Ο περιοδικός νόμος δηλώνει ότι «Οι φυσικές και χημικές ιδιότητες των στοιχείων είναι περιοδικές συναρτήσεις των ατομικών τους αριθμών».
Υπάρχουν επτά περίοδοι και δεκαοκτώ ομάδες στον περιοδικό πίνακα. Οι σειρές στον περιοδικό πίνακα ονομάζονται περίοδοι και οι στήλες ονομάζονται Ομάδες. Ο περιοδικός πίνακας έχει τέσσερις γενικές κατηγορίες με βάση τα υποφλοιώματα στα οποία έχει εισαχθεί το ηλεκτρόνιο σθένους.
Ο περιοδικός πίνακας ταξινομείται σε τέσσερα μπλοκ με βάση το υποκέλυφος που εισέρχεται το ηλεκτρόνιο σθένους. Είναι συγκεκριμένα μπλοκ s,p,d και f.
s Block Elements
Τα στοιχεία μπλοκ s βρίσκονται στην άκρα αριστερή πλευρά του περιοδικού πίνακα. Περιλαμβάνουν στοιχεία της ομάδας 1 (μέταλλα αλκαλίων), στοιχεία της ομάδας 2 (μέταλλα αλκαλικών γαιών), υδρογόνο και ήλιο. Ονομάζονται s μπλοκ στοιχεία επειδή τα ηλεκτρόνια σθένους εισέρχονται στο υποκέλυφος s. Η γενική ηλεκτρονική τους διαμόρφωση ns1-2.
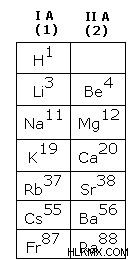
Ιδιότητες των στοιχείων μπλοκ s
Είναι μέταλλα με υψηλή αντίδραση.
Έχουν χαμηλά σημεία τήξης και βρασμού.
Είναι εξαιρετικοί αγωγοί του ηλεκτρισμού.
Σχηματίζουν κυρίως ιοντικές ενώσεις.
Δίνουν χαρακτηριστικό χρώμα στη φλόγα.
Είναι ηλεκτροθετικά και σχηματίζουν βασικό οξείδιο.
p Αποκλεισμός στοιχείων.
Τα στοιχεία του μπλοκ p βρίσκονται στην άκρα αριστερή πλευρά του περιοδικού πίνακα. Περιλαμβάνουν στοιχεία στην ομάδα 13 (οικογένεια βορίου), την ομάδα 14 (οικογένεια άνθρακα), την ομάδα 15 (οικογένεια αζώτου), την ομάδα 16 (χαλκογόνα), την ομάδα 17 (αλογόνα) και την ομάδα 18 (ευγενή αέρια).
Το τελευταίο ηλεκτρόνιο εισέρχεται στο τροχιακό p, εξ ου και το όνομα στοιχεία p-block.
Η γενική ηλεκτρονική διαμόρφωση είναι np1-6.
Ιδιότητες στοιχείων p μπλοκ
τα μπλοκ p περιλαμβάνουν μέταλλα, αμέταλλα και μεταλλοειδή.
Τα στοιχεία είναι γυαλιστερά και καλοί αγωγοί της θερμότητας και του ηλεκτρισμού.
Ο μεταλλικός χαρακτήρας αυξάνεται στην ομάδα.
Σχηματίζουν κυρίως ομοιοπολικές ενώσεις. Το οξυγόνο και τα αλογόνα τείνουν να σχηματίζουν ιοντικές ενώσεις με μέταλλα.
Εμφανίζουν μεταβλητές καταστάσεις οξείδωσης.
Η αντιδραστικότητα των μετάλλων μειώνεται στην ομάδα.
d Στοιχεία αποκλεισμού
Το μπλοκ d, που ονομάζεται επίσης μέταλλα μετάπτωσης, βρίσκεται μεταξύ των στοιχείων μπλοκ s και μπλοκ p. Το τελευταίο ηλεκτρόνιο από αυτά τα στοιχεία εισέρχεται στο προτελευταίο d υποκέλυφος και ως εκ τούτου έχουν τα ονομαζόμενα μπλοκ στοιχεία. Ονομάζονται μεταβατικά στοιχεία επειδή δείχνουν μια μετάβαση από εξαιρετικά δραστικά ιοντικά μέταλλα στο μπλοκ s σε μη ομοιοπολικά μέταλλα στο μπλοκ p.
Η γενική ηλεκτρονική διαμόρφωση του στοιχείου μπλοκ d είναι (n-1)1-10ns1-2.
Περιλαμβάνουν τα στοιχεία από την Ομάδα 3 έως την Ομάδα 13.
Υπάρχουν τέσσερις σειρές μέσα στο μπλοκ d που αφορούν την πλήρωση ηλεκτρονίων. Είναι σειρές 3d, 4d, 5d και 6d.
Πρώτη σειρά μετάβασης ή σειρά 3d – Scandium to Zinc
Δεύτερη μεταβατική σειρά ή σειρά 4d – Ύττριο σε κάδμιο
Τρίτη μεταβατική σειρά ή σειρά 5d – Lanthanum στον Mercury (εκτός από Lanthanoids)
Τέταρτη μεταβατική σειρά της σειράς 6d – Ακτίνιο σε κοπερνίκιο (εκτός από Ακτινοειδή)
<πίνακας>Ιδιότητες στοιχείων d μπλοκ
τα στοιχεία του μπλοκ είναι μέταλλα με υψηλό σημείο τήξης και βρασμού
Διαθέτουν όλα τα μεταλλικά χαρακτηριστικά, όπως ελαττότητα και ολκιμότητα. Έχουν καλή αντοχή σε εφελκυσμό.
Έχουν υψηλή θερμική και ηλεκτρική αγωγιμότητα.
Οι ενώσεις που σχηματίζονται είναι παραμαγνητικές.
Περιλαμβάνουν έγχρωμες ενώσεις και εμφανίζουν μεταβλητές καταστάσεις οξείδωσης.
Έχουν μεγάλη καταλυτική ισχύ και χρησιμοποιούνται ως καταλύτες σε πολλές αντιδράσεις.
f Στοιχεία αποκλεισμού
Τα στοιχεία μπλοκ f ή τα στοιχεία εσωτερικής μετάβασης βρίσκονται στο κάτω μέρος του περιοδικού πίνακα ξεχωριστά από τα άλλα μπλοκ. Στα στοιχεία μπλοκ f, το τελευταίο ηλεκτρόνιο εισέρχεται στο αντιπροτελευταίο υποκέλυφος f. Η γενική ηλεκτρονική διαμόρφωση είναι (n-2)1-14(n-1)d0-1ns2.
Τα στοιχεία μπλοκ f ταξινομούνται σε δύο με βάση το υποκέλυφος f το τελευταίο εισέρχεται ηλεκτρόνιο. Είναι 4f ή λανθανίδες και 5f ή ακτινίδες.
<πίνακας>Λανθανίδες
– Δημήτριο (Z=57) έως λουτέτιο (Z=71)
– η γενική ηλεκτρονική διαμόρφωση είναι 6s25d0-14f1-14
-Σχεδόν όλα τα στοιχεία δεν είναι ραδιενεργά, εκτός από το Promitium(Pm)
Ιδιότητες των Λανθανίδων
Είναι μαλακά ασημί-λευκά μέταλλα
Είναι κυρίως μη ραδιενεργά εκτός από το προμέθιο(Pm)
Το σημείο τήξης κυμαίνεται από 1000 K έως 1200 K
Από το λανθάνιο έως το λουτέτιο, παρατηρείται μείωση του ατομικού και ιοντικού μεγέθους. Αυτό το φαινόμενο ονομάζεται συστολή λανθανοειδών.
Ακτινίδες
– Θόριο (Z=90) έως Lawrencium (Z=103)
– Η γενική ηλεκτρονική διαμόρφωση είναι 7s26d0-15f1-14
Ιδιότητες ακτινιδών
Τα στοιχεία μετά το ουράνιο είναι ραδιενεργά και ονομάζονται στοιχεία υπερουρανίου
Είναι ασημί
Οι ακτινίδες είναι εξαιρετικά αντιδραστικές και η αντιδραστικότητα αυξάνεται όταν κονιοποιούνται σε λεπτή σκόνη
Υπάρχει μια μείωση στις ατομικές ακτίνες από το ακτίνιο στο λαυρένιο, γνωστή ως συστολή ακτινοειδών.
Συμπέρασμα
Ο περιοδικός πίνακας είναι μια συστηματική πίνακας διάταξης όλων των στοιχείων. Χωρίζεται σε τέσσερα μπλοκ:s, p, d και f. Αυτή η διαίρεση εξαρτάται από το κέλυφος που εισέρχεται το ηλεκτρόνιο σθένους. Στο μπλοκ s, το ηλεκτρόνιο εισέρχεται στο υποκέλυφος s. Είναι μέταλλα υψηλής αντίδρασης, συμπεριλαμβανομένων αλκαλίων, μετάλλων αλκαλικών γαιών, υδρογόνου και ηλίου.
Στα στοιχεία μπλοκ p, το τελευταίο ηλεκτρόνιο εισέρχεται στο υποκέλυφος p. Περιλαμβάνουν ομάδες 13 έως 18 και περιλαμβάνουν μέταλλα, αμέταλλα και μεταλλοειδή. Στο μπλοκ d, γνωστό και ως μέταλλα μετάπτωσης, το ηλεκτρόνιο σθένους εισέρχεται στο προτελευταίο υποκέλυφος d. Είναι μέταλλα με μεταβλητές καταστάσεις οξείδωσης και υψηλή καταλυτική ισχύ. Στα στοιχεία μπλοκ f ή εσωτερικά μεταβατικά στοιχεία, η είσοδος ηλεκτρονίων σθένους γίνεται στο προτελευταίο υποκέλυφος f. Διακρίνονται σε Λανθανίδες και Ακτινίδες.