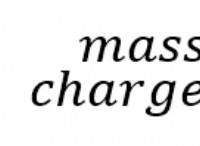Παρασκευή Υδρογονανθράκων – Αλκυνίων
Οι υδρογονάνθρακες είναι οργανικές ενώσεις που αποτελούνται από βασικά άτομα που ονομάζονται υδρογόνο και άνθρακες. Γενικά, αυτά είναι άχρωμα αέρια με σχεδόν καθόλου οσμή. Με βάση τους τύπους τους, οι υδρογονάνθρακες μπορεί να έχουν απλές ή πολύπλοκες δομές. Αυτά ταξινομούνται κυρίως σε τέσσερα κύρια μέρη - αλκένια, αλκάνια, αλκίνια και αρωματικά.
Τι είναι οι υδρογονάνθρακες;
Οι υδρογονάνθρακες μπορούν να περιγραφούν ως οργανικές ενώσεις που περιλαμβάνουν δύο άτομα – άνθρακα και υδρογόνο. Οι υδρογονάνθρακες ποικίλλουν ανάλογα με τη δομή τους που μπορεί να είναι είτε απλοί είτε σύνθετοι. Επιπλέον, μπορούν να χωριστούν σε έξι κύρια μέρη:Κορεσμένους υδρογονάνθρακες, Ακόρεστους υδρογονάνθρακες, Κυκλοαλκάνια, Αρωματικούς υδρογονάνθρακες, Αλειφατικούς υδρογονάνθρακες και Αλικυκλικούς υδρογονάνθρακες.
Τι είναι τα Αλκίνια;
Ανήκοντας στην οικογένεια της οργανικής χημείας, τα αλκίνια ή αλκύνια είναι ακόρεστοι υδρογονάνθρακες που περιέχουν τουλάχιστον έναν τριπλό δεσμό άνθρακα-άνθρακα. Ο τύπος για τα αλκίνια είναι CnH2n-2. Ο τριπλός δεσμός αναφέρεται επίσης ως ακετυλενικός δεσμός. Στην οικογένεια των αλκυνίων, το αιθύλιο είναι το πρώτο μέλος. Ο χημικός τύπος του είναι C2H2.
Ιδιότητες των Αλκυνίων
Τα αλκίνια είναι μοναδικά λόγω του υβριδισμού. Η αντοχή του μη πολικού δεσμού του αλκυνίου, η οξύτητά του και η γραμμικότητά του οφείλεται στους τριπλούς δεσμούς που εμφανίζονται σε αυτές τις ενώσεις.
Όταν βρίσκονται στο νερό, αυτές οι ενώσεις είναι αδιάλυτες, ενώ, σε πολικούς διαλύτες, είναι ελαφρώς διαλυτές. Τα αλκίνια έχουν την ικανότητα να διαλύονται σε οργανικούς διαλύτες επειδή η πυκνότητα του διαλύματος είναι μικρότερη.
Τα αλκίνια έχουν υψηλότερο σημείο βρασμού από τα αλκάνια και τα αλκένια. Για παράδειγμα, το σημείο βρασμού του αιθανίου είναι -88,6°C, το σημείο βρασμού του αιθενίου είναι -103,7°C και το σημείο βρασμού του αιθανίου είναι -84°C. Καθώς τα άτομα άνθρακα αυξάνονται, το σημείο βρασμού αυτών των ενώσεων αυξάνεται επίσης.
Η οξύτητα των αλκυνίων είναι πολύ μεγαλύτερη από αυτή των αλκανίων και των αλκενίων. Η τιμή pKa του αιθανίου είναι 50, καθιστώντας το λιγότερο όξινο, ενώ η τιμή pKa του αιθενίου είναι 44. Από την άλλη πλευρά, το αιθένιο είναι το πιο όξινο, του οποίου η τιμή pKa είναι 25.
Παρασκευή Αλκυνίων
Υπάρχουν διάφορες μέθοδοι που εξετάζονται για την παρασκευή αλκυνίων. Λόγω των αντιβακτηριακών, αντιμυκητιασικών και αντιπαρασιτικών ιδιοτήτων του, η σύνθεση των Αλκυνών είναι εξαιρετικά χρήσιμη. Εδώ είναι μερικές από τις μεθόδους που χρησιμοποιούνται για την παρασκευή αλκυνίων.
Αφυδροαλογόνωση αλκυλοδιαλογονιδίων
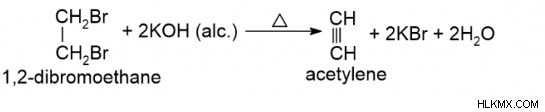
Η πρώτη μέθοδος είναι η αφυδροαλογόνωση των αλκυλοδιαλογονιδίων, όπου τα αλκένια αντιδρούν με το αλογόνο. Εξαιτίας αυτής της αντίδρασης, επιτυγχάνεται ένα άλλο αλκάνιο που ονομάζεται "υποκατεστημένο αλκάνιο". Τα σχηματισμένα αλκίνια υφίστανται περαιτέρω επεξεργασία μέσω του αλκοολικού ΚΟΗ για τον σχηματισμό των υποκατεστημένα αλκενίων. Αργότερα, αντιδρά με το αμίδιο του νατρίου για να σχηματίσει αλκίνια. Δεδομένου ότι το υδρογόνο δεν υπάρχει μαζί με το αλογόνο, η διαδικασία αναφέρεται ως αφυδροαλογόνωση.
Ακολουθεί η αφυδροαλογόνωση των αλκυλοδιαλογονιδίων –
Παρασκευή από καρβίδιο του ασβεστίου
Οι ειδικοί προτιμούν αυτή τη μέθοδο όταν τα αλκίνια παράγονται σε μεγαλύτερη κλίμακα. Ο χημικός τύπος του καρβιδίου του ασβεστίου είναι CaC2. Ο ασβέστης θερμαίνεται παρουσία οπτάνθρακα για να παρασκευαστεί το καρβίδιο του ασβεστίου. Μετά από αυτό, το καρβίδιο του ασβεστίου αντιδρά με το νερό για να πάρει ακετυλένιο. Ακολουθούν οι αντιδράσεις για την παρασκευή ακετυλενίου από το καρβίδιο του ασβεστίου –
CaCO3 → CaO + CO2
CaO + 3C → CaC2 + CO
CaC2 + 2H2O → Ca(OH)2 + C2H2
Παρασκευή από διαλογονίδια Vicinal
Κατά τη διάρκεια αυτής της διαδικασίας, τα αλκένια αντιδρούν με ένα αλογόνο. Η διαδικασία της αφυδροαλογόνωσης εκτελείται για τη λήψη αλκυνίων και πραγματοποιείται σε δύο κύρια στάδια.
Το πρώτο βήμα στην παρασκευή αλκυνίων περιλαμβάνει την προετοιμασία των ακόρεστων αλογονιδίων. Τα σχηματισμένα αλογονίδια διαθέτουν το αλογόνο, το οποίο συνδέεται περαιτέρω με τον άνθρακα με διπλούς δεσμούς. Τέτοια αλογονίδια αναφέρονται ως βινυλικά αλογονίδια. Σημειώστε ότι αυτά τα αλογονίδια δεν είναι δραστικά στη φύση, αλλά είναι φτιαγμένα για να αντιδρούν με μια ισχυρή βάση που σχηματίζει αλκίνια. Για να μετατραπούν τα μικρά αλκίνια σε μεγαλύτερα, χρησιμοποιούνται μεταλλικά ακετυλίδια στο δεύτερο βήμα.
Ακολουθεί η παρασκευή αλκυνίων από γειτονικά διαλογονίδια –

Διαφορά μεταξύ Αλκενίων και Αλκανίων
Τα αλκένια προέρχονται από την οικογένεια των υδρογονανθράκων. Τα αλκένια έχουν τουλάχιστον έναν διπλό δεσμό μεταξύ των δύο γειτονικών ατόμων άνθρακα. Ο χημικός τύπος για τα αλκένια είναι CnH2n. Τα αλκάνια μπορούν να περιγραφούν ως μια οργανική ένωση που διαθέτει ενώσεις υδρογόνου και άνθρακα μονού δεσμού. Το CnH2n+2 είναι ο τύπος των Αλκανίων. Χωρίζεται περαιτέρω σε τρεις μεγάλες ομάδες - κυκλοαλκάνια, διακλαδισμένα αλκάνια και αλκάνια αλυσίδας.
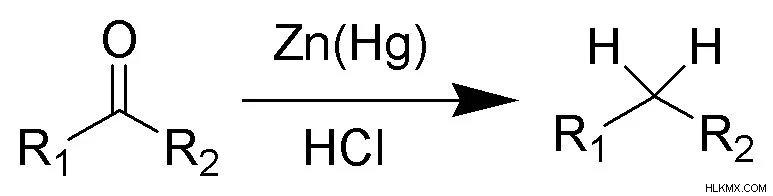
Τι είναι η μείωση του Clemmensen
Η αναγωγή του Clemmensen είναι η αντίδραση που χρησιμοποιείται για την αναγωγή κετονών ή αλδεΰδων στα αλκάνια χρησιμοποιώντας υδροχλωρικό οξύ και αμάλγαμα ψευδαργύρου. Αυτή η αντίδραση πήρε το όνομά της από τον Erik Christian Clemmensen, έναν Δανό χημικό.
Συμπέρασμα
Οι υδρογονάνθρακες είναι οργανικές ενώσεις που αποτελούνται από δύο άτομα - υδρογόνο και άνθρακα. Τα αλκίνια είναι ακόρεστοι υδρογονάνθρακες που περιέχουν τουλάχιστον έναν τριπλό δεσμό άνθρακα-άνθρακα. Υπάρχουν διάφορες μέθοδοι παρασκευής αλκυνίων. Μερικές από αυτές τις μεθόδους περιλαμβάνουν αφυδροαλογόνωση αλκυλοδιαλογονιδίων, παρασκευή αλκυνίων από καρβίδια ασβεστίου και παρασκευή αλκυνίων από διαλογονίδια Vicinal. Ο τύπος για τα αλκίνια είναι CnH2n-2.