Μοριακή αγωγιμότητα
Στη χημεία, η μοριακή αγωγιμότητα είναι η αγωγιμότητα ενός όγκου διαλύματος που περιέχει 1 mole διαλυμένου ηλεκτρολύτη, όταν τοποθετείται μεταξύ δύο παράλληλων ηλεκτροδίων.
Τι είναι η Μοριακή αγωγιμότητα;
Η μοριακή αγωγιμότητα μπορεί να ονομαστεί ως η ιδιότητα αγωγιμότητας ή η αγώγιμη ισχύς όλων των ιόντων που παράγονται με τη διάσπαση ενός mol ηλεκτρολύτη σε ένα διάλυμα. Έχει την ιδιότητα ενός διαλύματος ηλεκτρολύτη που χρησιμοποιείται για τον προσδιορισμό της απόδοσης ενός ηλεκτρολύτη στην αγωγή του ηλεκτρισμού σε ένα διάλυμα. Επομένως, δεν είναι σταθερό.
Τύπος μοριακής αγωγιμότητας
Η έκφραση που δίνεται παρακάτω αντιπροσωπεύει τον μαθηματικά τύπο μοριακής αγωγιμότητας.
Λm =K / C
Έτσι, όπου K =η συγκεκριμένη αγωγιμότητα;
C =η συγκέντρωση σε mole ανά λίτρο.
Σε γενικές γραμμές, η μοριακή αγωγιμότητα ενός ηλεκτρολυτικού διαλύματος είναι η αγωγιμότητα του όγκου του διαλύματος που περιλαμβάνει ένα μοναδιαίο mol ηλεκτρολύτη που βρίσκεται μεταξύ δύο ηλεκτροδίων διατομής μονάδας επιφάνειας ή σε εύρος ενός εκατοστό μεταξύ τους.
Ως εκ τούτου, η μονάδα γραμμομοριακής αγωγιμότητας είναι S⋅m2⋅mol-1.
Παραλλαγή της μοριακής αγωγιμότητας με συγκέντρωση
Ασθενείς και ισχυροί ηλεκτρολύτες της μοριακής αγωγιμότητας αυξάνονται με μείωση της συγκέντρωσης ή της αραίωσης. Όπως μάθατε προηγουμένως, η μοριακή αγωγιμότητα είναι η αγωγιμότητα που δίνεται από ένα mole ιόντων. Αμέσως μετά την αραίωση, θα εξακολουθεί να εξετάζει το ακριβές μοναδιαίο mole ιόντων. Ωστόσο, η αυξημένη αραίωση επηρεάζει τη διάσπαση περαιτέρω ηλεκτρολυτών σε ιόντα και αυξάνει αποτελεσματικά τον αριθμό των ενεργών ιόντων στο διάλυμα. Επομένως, αυτό προσδίδει μεγαλύτερη αγωγιμότητα.
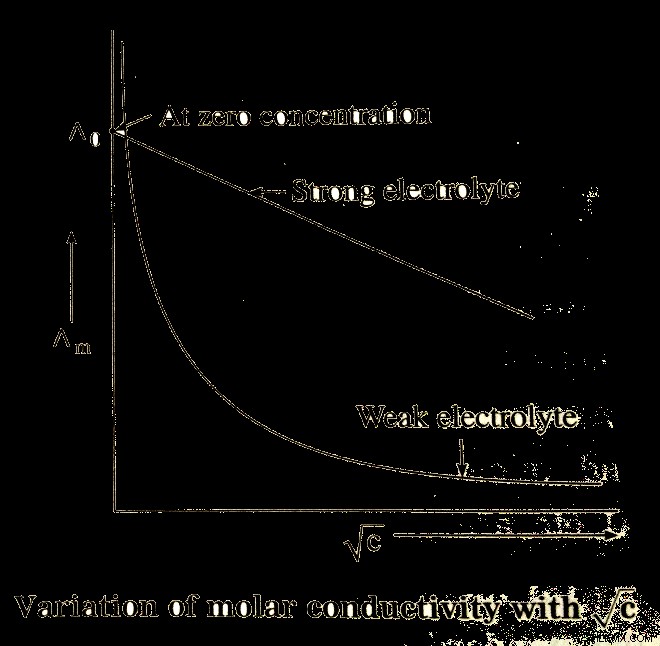
Το παραπάνω γράφημα δείχνει ότι για ισχυρούς ηλεκτρολύτες, η μοριακή αγωγιμότητα αυξάνεται σταδιακά με την αραίωση. Εάν το Eom είναι η περιοριστική μοριακή αγωγιμότητα, δηλαδή η γραμμομοριακή αγωγιμότητα σε μηδενική συγκέντρωση, κατά συνέπεια η γενική εξίσωση για το γράφημα του ισχυρού ηλεκτρολύτη μπορεί να μεταφερθεί μέσω του νόμου του Kohlrausch.
Λm =Eo m – A √ c
Πού,
A =η κλίση του οικοπέδου.
Εξαρτάται από το είδος του ηλεκτρολύτη σε μια δεδομένη θερμοκρασία για έναν δεδομένο διαλύτη.
Ασθενείς ηλεκτρολύτες, ωστόσο, η μοριακή αγωγιμότητα παραμένει σε χαμηλότερες συγκεντρώσεις. Αντίθετα, τέτοιοι ηλεκτρολύτες έχουν χαμηλότερη μοριακή αγωγιμότητα σε υψηλότερες συγκεντρώσεις επειδή υπάρχει μειωμένος βαθμός διάστασης.
Στην ειδική αγωγιμότητα, αναγνωρίζεται ότι η αγωγιμότητα αυξάνεται καθώς αυξάνεται η συγκέντρωση του ηλεκτρολύτη. Εξαρτάται από τον αριθμό των ιόντων που υπάρχουν στη μονάδα όγκου του διαλύματος. Κατά την αραίωση, η διάσταση αυξάνεται, επηρεάζοντας τα ιόντα που μεταφέρουν ρεύμα να αυξηθούν στο διάλυμα. Αλλά μόνο λόγω της αραίωσης, ο αριθμός των ιόντων που υπάρχουν σε μια μονάδα όγκου του διαλύματος μειώνεται. Αυτό έχει ως αποτέλεσμα τη μείωση της αγωγιμότητας.
Στην περίπτωση των Ισχυρών ηλεκτρολυτών, η αύξηση της συγκέντρωσης διεγείρει μια απότομη αύξηση της αγωγιμότητας. Ωστόσο, σε χαμηλότερες συγκεντρώσεις, οι ασθενείς ηλεκτρολύτες διατηρούν πολύ χαμηλές τιμές ειδικής αγωγιμότητας και η τιμή αυξάνεται σκόπιμα καθώς αυξάνεται η συγκέντρωση. Αυτό συνέβη ως αύξηση του αριθμού των ενεργών ιόντων στο διάλυμα λόγω συγκέντρωσης.
Ειδική αγωγιμότητα
Η ειδική αγωγιμότητα είναι το μέτρο της ικανότητας ενός υλικού να μεταφέρει ηλεκτρισμό. Αντιπροσωπεύεται από το σύμβολο "K". Ως εκ τούτου, εξ ορισμού, G=R=p.
Η έκταση στην οποία ένα δεδομένο δείγμα ηλεκτρολυτικού διαλύματος μπορεί να άγει ηλεκτρικό ρεύμα ονομάζεται αγωγιμότητα, ενώ το αντίστροφο του βαθμού στον οποίο το δεδομένο δείγμα ηλεκτρολυτικού διαλύματος μπορεί να αντισταθεί στη ροή του ηλεκτρικού ρεύματος είναι που ονομάζεται αντίστασή του. Άρα μπορεί να συναχθεί το συμπέρασμα ότι η αγωγιμότητα είναι η αντίστροφη αντίσταση του συγκεκριμένου ηλεκτρολυτικού διαλύματος. Η μονάδα SI θα έχει αγωγιμότητα S (Siemens).
Η μονάδα SI ειδικής αγωγιμότητας είναι η Siemens ανά μέτρο, καλύτερα ως S/m.
Ανάλογα με τους παράγοντες ειδικής αγωγιμότητας ενός ηλεκτρολυτικού διαλύματος
Η συγκέντρωση και η φύση του ηλεκτρολύτη στο διάλυμα
Μέγεθος ιόντων εντός του διαλύματος
Η φύση του διαλύτη και το ιξώδες του
Η θερμοκρασία του ηλεκτρολυτικού διαλύματος
Επομένως, διαφορετικά ηλεκτρολυτικά διαλύματα έχουν διαφορετικές συγκεντρώσεις και περιέχουν διαφορετικούς αριθμούς ιόντων. Λόγω αυτού του παράγοντα, η ειδική αγωγιμότητα δεν είναι κατάλληλη ποσότητα για τη σύγκριση της αγωγιμότητας διαφορετικών ηλεκτρολυτικών διαλυμάτων. Λόγω αυτού, εισάγεται μοριακή αγωγιμότητα.
Ηλεκτρολυτική αγωγιμότητα
Όταν εφαρμόζεται τάση στα ηλεκτρόδια που βυθίζονται σε ένα ηλεκτρολυτικό διάλυμα, τα ιόντα του ηλεκτρολύτη μετακινούνται και, επομένως, το ηλεκτρικό ρεύμα ρέει μέσω του ηλεκτρολυτικού διαλύματος.
Η ισχύς των ηλεκτρολυτών να μεταφέρουν ηλεκτρικό ρεύμα ονομάζεται αγωγιμότητα ή αγωγιμότητα. Τα ηλεκτρολυτικά διαλύματα υπακούουν στο νόμο του Ohm.
Βασίζεται στην εξίσωση ή τη θεωρία Arrhenius που εξηγεί ότι όταν ένας ουδέτερος ηλεκτρολύτης διαλύεται στο νερό, τα μόρια του ηλεκτρολύτη χωρίζονται σε διαφορετικά φορτισμένα ιόντα. Τα θετικά ιόντα ονομάζονται κατιόντα και τα αρνητικά ονομάζονται ανιόντα αντίστοιχα. Τα ιόντα υπάρχουν ήδη στον ηλεκτρολύτη, ωστόσο, δεσμεύονται από ηλεκτροστατική δύναμη και ως εκ τούτου είναι ουδέτερα.
Ισοδύναμη αγωγιμότητα στην ηλεκτρολυτική αγωγιμότητα
Όπως γνωρίζουμε ότι η ηλεκτρολυτική αγωγιμότητα ορίζεται ως η αγώγιμη ισχύς όλων των ιόντων που παράγονται από τη διάλυση 1 g ισοδυνάμου ενός ηλεκτρολύτη σε διάλυμα, ωστόσο η ισοδύναμη αγωγιμότητα ορίζεται ως η αγωγιμότητα ενός όγκου διαλύματος που περιέχει ένα ισοδύναμο βάρος διαλυμένης ουσίας όταν τοποθετείται ανάμεσα σε δύο παράλληλα ηλεκτρόδια σε απόσταση 1 cm μεταξύ τους και αρκετά μεγάλο ώστε να περιέχει ολόκληρο το διάλυμα μεταξύ τους.
Συμπέρασμα
Επομένως, Μοριακή αγωγιμότητα είναι η συγκεκριμένη αγωγιμότητα που διαιρείται με τη συγκέντρωση σε mole ανά λίτρο όπου υπάρχουν δύο ηλεκτρόδια με θετικό και αρνητικό φορτίο, αντίστοιχα διατομής μονάδας επιφάνειας 1 cm μεταξύ τους .




