Προϋποθέσεις σύνδεσης υδρογόνου
Με απλά λόγια, ο δεσμός υδρογόνου είναι ο σχηματισμός δεσμών υδρογόνου. Εμφανίζεται κυρίως μεταξύ ενός ηλεκτραρνητικού και ενός ατόμου υδρογόνου. Μερικά από τα κοινά ηλεκτραρνητικά άτομα είναι το φθόριο, το χλώριο και το οξυγόνο. Σε σύγκριση με τον ομοιοπολικό ή ιοντικό δεσμό, ο δεσμός υδρογόνου είναι γενικά πιο αδύναμος. Ωστόσο, είναι ισχυρότερο από τις δυνάμεις van der Waals. Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού.
Σχετικά με το θέμα των συνθηκών για δεσμούς υδρογόνου, μάθετε για τους δεσμούς υδρογόνου και τις διάφορες συνθήκες σχηματισμού δεσμών υδρογόνου, μαζί με σχετικά θέματα λεπτομερώς.
Εξηγήστε τους δεσμούς υδρογόνου
Ο δεσμός υδρογόνου μπορεί να περιγραφεί ως η διαδικασία σχηματισμού δεσμών υδρογόνου που αποτελούν ειδική κατηγορία ελκτικής διαμοριακής δύναμης που προκύπτει λόγω της αλληλεπίδρασης μεταξύ του ατόμου υδρογόνου και ενός εξαιρετικά ηλεκτραρνητικού ατόμου. Για παράδειγμα, στην περίπτωση των μορίων του νερού, που χημικά σημειώνονται ως H2O, το υδρογόνο συνδέεται ομοιοπολικά με το ηλεκτραρνητικό άτομο οξυγόνου.
Σαν αποτέλεσμα, ο δεσμός υδρογόνου αυξάνεται στα μόρια του νερού λόγω των αλληλεπιδράσεων διπόλου-διπόλου μεταξύ των ατόμων οξυγόνου και των ατόμων υδρογόνου. Σύμφωνα με τους ειδικούς, ο δεσμός υδρογόνου είναι ως επί το πλείστον ισχυρός σε σύγκριση με τις κανονικές δυνάμεις διασποράς και διπόλου-διπόλου. Ωστόσο, φαίνεται να είναι αδύναμο αν συγκριθεί με ιοντικούς δεσμούς ή αληθινούς ομοιοπολικούς δεσμούς. Επιπλέον, ο δεσμός υδρογόνου χωρίζεται σε δύο κύρια μέρη. Αυτά περιλαμβάνουν-
Ο Διαμοριακός Δεσμός Υδρογόνου είναι ένας τύπος δεσμού υδρογόνου όπου λαμβάνει χώρα μεταξύ διαφορετικών μορίων που έχουν είτε τις ίδιες είτε διαφορετικές ενώσεις.
Ο ενδομοριακός δεσμός υδρογόνου είναι ένας άλλος τύπος δεσμού υδρογόνου που εμφανίζεται κυρίως μόνο εντός του μορίου. Αυτός ο τύπος δεσμού υδρογόνου λαμβάνει χώρα σε ενώσεις που έχουν δύο ομάδες.
Συνθήκες δεσμού υδρογόνου
Στο μόριο όπου το άτομο είναι στενά συνδεδεμένο με το ηλεκτραρνητικό άτομο, το κοινό κομμάτι ενός ηλεκτρονίου έλκεται. Ως αποτέλεσμα, το άκρο του μορίου φαίνεται ελαφρώς αρνητικό, ενώ το άλλο μέρος γίνεται θετικό. Και τα δύο άκρα ελκύουν το ένα το άλλο, γεγονός που οδηγεί στο σχηματισμό ενός αδύναμου δεσμού μεταξύ τους. Ο δεσμός που εξηγείται αναφέρεται ως δεσμός υδρογόνου.
Λόγω του δεσμού υδρογόνου, ένα μεμονωμένο άτομο υδρογόνου συνδέεται στενά με δύο ηλεκτραρνητικά άτομα ταυτόχρονα. Από τα δύο, το ένα συνδέεται με τον ομοιοπολικό δεσμό, ενώ άλλο είναι από τον δεσμό υδρογόνου. Ακολουθούν δύο κύριες συνθήκες σύνδεσης υδρογόνου -
Το μέγεθος του ηλεκτροαρνητικού ατόμου θα πρέπει να είναι μικρό. Όσο μικρότερο θα είναι το μέγεθος των ηλεκτραρνητικών ατόμων, τόσο μεγαλύτερη θα είναι η ηλεκτροστατική έλξη.
Κάθε μόριο θα πρέπει να έχει ένα εξαιρετικά ηλεκτραρνητικό άτομο συνδεδεμένο με το άτομο υδρογόνου. Όσο μεγαλύτερη θα είναι η ηλεκτραρνητικότητα, τόσο μεγαλύτερη είναι η πόλωση του μορίου.
Λόγω του δεσμού υδρογόνου, τα μόρια του καρβοξυλικού οξέος εμφανίζονται πιο αμυδρά. Οι κυτταρικές ομάδες όλων αυτών των ενώσεων έχουν διπλάσιο μέγεθος.
Παραδείγματα δεσμών υδρογόνου
Ακολουθεί η λίστα με μερικά πιο κοινά παραδείγματα δεσμών υδρογόνου –
-
Δεσμός υδρογόνου στο νερό
Ένα μόριο νερού έχει ένα ηλεκτραρνητικό άτομο οξυγόνου συνδεδεμένο με άτομα υδρογόνου. Δεδομένου ότι το άτομο οξυγόνου τείνει να έλκει το κοινό ζεύγος του ηλεκτρονίου, το άκρο του γίνεται αρνητικό. Ωστόσο, το άτομο υδρογόνου γίνεται θετικό.
-
Δεσμός υδρογόνου σε καρβοξυλικό οξύ και αλκοόλες
Το αλκοόλ αναφέρεται ως οργανικό μόριο με ομάδα -ΟΗ. Γενικά, σε περίπτωση που οποιοδήποτε μόριο έχει άτομο υδρογόνου είτε συνδέεται απευθείας με άζωτο είτε με οξυγόνο. Αργότερα, ο δεσμός υδρογόνου γίνεται ευκολότερος.
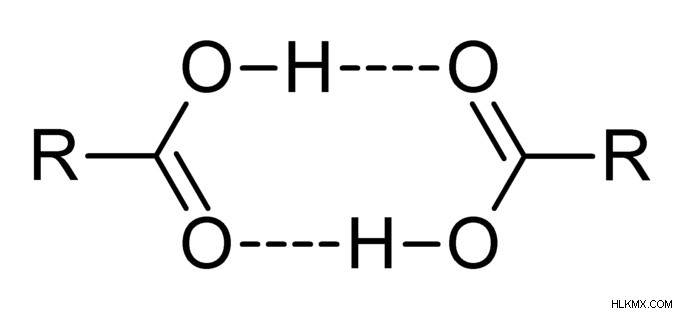
-
Δεσμός υδρογόνου στο υδροφθόριο
Δεδομένου ότι το φθόριο έχει την υψηλότερη τιμή ηλεκτραρνητικότητας, οδηγεί στο σχηματισμό του ισχυρότερου δεσμού υδρογόνου.
H−F···H−F···H−F
-
Δεσμός υδρογόνου στην αμμωνία
Έχει άζωτο ηλεκτραρνητικού ατόμου συνδεδεμένο με άτομα υδρογόνου.
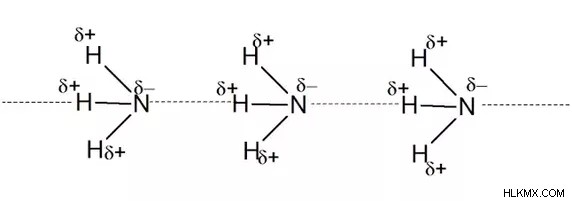
-
Δεσμός υδρογόνου στο πολυμερές
Προκειμένου να προσδιοριστούν οι ιδιότητες και οι τρισδιάστατες δομές που αποκτώνται από φυσικές και συνθετικές πρωτεΐνες, ο δεσμός υδρογόνου είναι ένας κρίσιμος παράγοντας. Παίζει επίσης σημαντικό ρόλο στον καθορισμό της δομής της κυτταρίνης μαζί με παράγωγα πολυμερή, συμπεριλαμβανομένου του λιναριού ή του βαμβακιού.
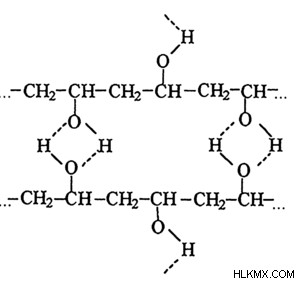
Οι ενώσεις με δεσμούς υδρογόνου έχουν υψηλό σημείο βρασμού και τήξης;
Οι ενώσεις που συνδέονται με υδρογόνο εμφανίζουν γενικά εξαιρετικά υψηλά σημεία τήξης και βρασμού. Αυτό οφείλεται στο γεγονός ότι απαιτείται μεγαλύτερη ποσότητα ενέργειας για να σπάσουν οι δεσμοί. Εφόσον υπάρχει δεσμός υδρογόνου, το σημείο βρασμού μεταξύ των οξέων αλογόνου είναι γενικά υψηλό.
Συμπέρασμα
Ο δεσμός υδρογόνου είναι η διαδικασία σχηματισμού δεσμών υδρογόνου, οι οποίοι αποτελούν την ειδική κατηγορία μιας ελκτικής διαμοριακής δύναμης που προκύπτει λόγω της αλληλεπίδρασης διπόλου-διπόλου μεταξύ του ατόμου υδρογόνου και ενός εξαιρετικά ηλεκτραρνητικού ατόμου. Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού. Εμφανίζεται κυρίως μεταξύ ενός ηλεκτραρνητικού και ενός ατόμου υδρογόνου.
Μερικά από τα κοινά παραδείγματα δεσμών υδρογόνου είναι ο δεσμός υδρογόνου στο υδροφθόριο, ο δεσμός υδρογόνου στο νερό, ο δεσμός υδρογόνου στην αμμωνία, ο δεσμός υδρογόνου στο πολυμερές και ούτω καθεξής. Υπάρχουν κυρίως τρεις προϋποθέσεις για το σχηματισμό δεσμών υδρογόνου, τις οποίες συζητήσαμε αναλυτικά. Στο τελευταίο μέρος, συζητήσαμε επίσης πώς οι ενώσεις με δεσμούς υδρογόνου έχουν υψηλό σημείο βρασμού και τήξης. Ελπίζουμε ότι αυτό μας βοήθησε να κατανοήσουμε καλύτερα τις συνθήκες για τους δεσμούς υδρογόνου.





