Διαφορά μεταξύ αιθανίου και αιθενίου
Κύρια διαφορά – Αιθάνης εναντίον Αιθέν
Οι υδρογονάνθρακες είναι μόρια που αποτελούνται από άτομα άνθρακα (C) και υδρογόνου (Η). Η πλειονότητα των υδρογονανθράκων βρίσκεται στο αργό πετρέλαιο. Το αιθάνιο και το αιθένιο είναι τέτοιοι υδρογονάνθρακες που έχουν απλές μοριακές δομές αλλά είναι πολύ χρήσιμοι σε πολλές βιομηχανίες. Το αιθάνιο είναι ένας κορεσμένος υδρογονάνθρακας. Δεν έχει διπλούς δεσμούς. Το αιθένιο είναι ένας ακόρεστος υδρογονάνθρακας. Έχει διπλό δέσιμο. Ωστόσο, και οι δύο είναι αλειφατικοί υδρογονάνθρακες αφού δεν είναι κυκλικές δομές. Η κύρια διαφορά μεταξύ αιθανίου και αιθενίου είναι ότι τα άτομα άνθρακα του αιθανίου είναι sp υβριδισμένα ενώ τα άτομα άνθρακα στο αιθένιο είναι sp υβριδισμένα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Αιθάνι
– Ορισμός, Ιδιότητες, Εφαρμογές
2. Τι είναι το αιθένιο
– Ορισμός, Ιδιότητες, Εφαρμογές
3. Ποιες είναι οι ομοιότητες μεταξύ αιθανίου και αιθενίου
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ αιθανίου και αιθενίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλειφατικό, αιθάνιο, αιθένιο, αιθυλένιο, υβριδισμός, υδρογονάνθρακες, δεσμός Pi, δεσμός σίγμα 
Τι είναι το αιθάνιο
Το αιθάνιο είναι ένας υδρογονάνθρακας που αποτελείται από δύο άτομα άνθρακα και έξι άτομα υδρογόνου. Είναι ένας κορεσμένος υδρογονάνθρακας που δεν έχει διπλούς δεσμούς στη δομή του. Τα δύο άτομα άνθρακα συνδέονται μεταξύ τους μέσω ενός ομοιοπολικού δεσμού. Τα άτομα υδρογόνου συνδέονται με τα άτομα άνθρακα μέσω απλών δεσμών. Τρία άτομα υδρογόνου συνδέονται σε κάθε άνθρακα. Τα άτομα άνθρακα του αιθανίου υβριδίζονται sp. Επομένως, δεν υπάρχουν μη υβριδισμένα τροχιακά p για να σχηματίσουν δεσμούς pi. Επομένως, υπάρχουν μόνο δεσμοί σίγμα στο αιθάνιο.
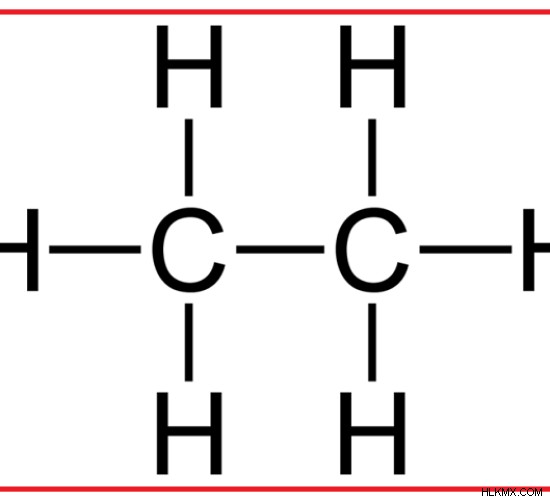
Εικόνα 1:Μοριακή δομή του αιθανίου
Η μοριακή μάζα του αιθανίου είναι περίπου 30,07 g/mol. Είναι ένα άχρωμο και άοσμο αέριο σε θερμοκρασία δωματίου και ατμοσφαιρική πίεση. Το σημείο τήξης του αιθανίου είναι περίπου -182,8 C. Ο χημικός τύπος του αιθανίου δίνεται ως C2 H6 . Δεδομένου ότι δεν υπάρχουν διπλοί δεσμοί, το αιθάνιο μπορεί να κατηγοριοποιηθεί ως αλκάνιο. Το αιθάνιο είναι το δεύτερο πιο σημαντικό συστατικό του φυσικού αερίου.
Το αιθάνιο είναι εύφλεκτο. επομένως, είναι εύφλεκτο. Είναι συστατικό του φυσικού αερίου. Το αιθάνιο χρησιμοποιείται επίσης ως αντιδραστήριο για την παραγωγή αιθυλενίου. Δεδομένου ότι το αιθυλένιο είναι απαραίτητο συστατικό σε έναν αριθμό βιομηχανιών, είναι πολύ σημαντικό ως αντιδραστήριο. Επιπλέον, το αιθάνιο είναι ένα ψυκτικό μέσο που χρησιμοποιείται σε συστήματα ψύξης που προκαλούν ψύξη.
Τι είναι το αιθένιο
Το αιθένιο είναι ένας υδρογονάνθρακας που αποτελείται από δύο άτομα άνθρακα και τέσσερα άτομα υδρογόνου. Ο χημικός τύπος του αιθενίου είναι C2 H4 . Τα δύο άτομα άνθρακα συνδέονται μεταξύ τους μέσω διπλού δεσμού. Επομένως, το αιθένιο είναι ένας ακόρεστος υδρογονάνθρακας. Τα δύο άτομα άνθρακα υβριδίζονται sp. Η μοριακή γεωμετρία του αιθενίου είναι επίπεδη.

Εικόνα 2:Μοριακή δομή του αιθενίου
Η μοριακή μάζα του αιθενίου είναι περίπου 28,05 g/mol. Το σημείο τήξης του αιθενίου είναι -169,2C. Σε θερμοκρασία δωματίου και ατμοσφαιρική πίεση, το αιθένιο είναι ένα άχρωμο αέριο με χαρακτηριστική οσμή. Η γωνία σύνδεσης μεταξύ των δεσμών αιθενίου είναι περίπου 121,3. Δεδομένου ότι τα άτομα άνθρακα αποτελούνται από μη υβριδισμένα τροχιακά p, αυτά τα τροχιακά μπορούν να σχηματίσουν έναν δεσμό pi μεταξύ των δύο ατόμων άνθρακα. Αυτός ο διπλός δεσμός προκαλεί την αντιδραστικότητα του αιθενίου.
Η κοινή ονομασία για το αιθένιο είναι αιθυλένιο . Χρησιμοποιείται στην παραγωγή πολυμερών υλικών όπως το πολυαιθυλένιο μέσω του πολυμερισμού μονομερούς αιθενίου. Το αιθυλένιο παίζει επίσης σημαντικό ρόλο στα φυτά ως ορμόνη που ρυθμίζει την ωρίμανση των καρπών.
Ομοιότητες μεταξύ αιθανίου και αιθενίου
- Τα μόρια αιθανίου και αιθενίου αποτελούνται από άτομα άνθρακα και υδρογόνου.
- Και τα δύο αποτελούνται από δύο άτομα άνθρακα.
- Και οι δύο είναι υδρογονάνθρακες.
- Και τα δύο είναι αλειφατικά οργανικά μόρια.
Διαφορά μεταξύ αιθανίου και αιθενίου
Ορισμός
Αιθάνιο: Το αιθάνιο είναι ένας υδρογονάνθρακας που αποτελείται από δύο άτομα άνθρακα και έξι άτομα υδρογόνου.
Αιθένιο : Το αιθένιο είναι ένας υδρογονάνθρακας που αποτελείται από δύο άτομα άνθρακα και τέσσερα άτομα υδρογόνου.
Χημικός τύπος
Αιθάνιο: Ο χημικός τύπος του αιθανίου είναι C2 H6 .
Αιθένιο : Ο χημικός τύπος του αιθενίου είναι C2 H4 .
Υβριδισμός άνθρακα
Αιθάνιο: Τα άτομα άνθρακα του αιθανίου υβριδίζονται sp.
Αιθένιο : Τα άτομα άνθρακα του αιθενίου είναι sp υβριδοποιημένα.
Μοριακή μάζα
Αιθάνιο: Η μοριακή μάζα του αιθανίου είναι περίπου 30,07 g/mol.
Αιθένιο : Η μοριακή μάζα του αιθενίου είναι περίπου 28,05 g/mol.
Σημείο τήξης
Αιθάνιο: Το σημείο τήξης του αιθανίου είναι περίπου -182,8 C.
Αιθένιο : Το σημείο τήξης του αιθενίου είναι περίπου -169,2 C.
Γωνία δεσμού
Αιθάνιο: Η γωνία δεσμού του δεσμού H-C-C στο αιθάνιο είναι περίπου 109,6.
Αιθένιο : Η γωνία σύνδεσης του δεσμού H-C-C στο αιθένιο είναι περίπου 121,7.
Μήκος δεσμού C-C
Αιθάνιο: Το μήκος του δεσμού C-C στο αιθάνιο είναι περίπου 154 pm.
Αιθένιο : Το μήκος του δεσμού C-C στο αιθένιο είναι περίπου 133 pm.
Μήκος δεσμού C-H
Αιθάνιο: Το μήκος του δεσμού C-H στο αιθάνιο είναι περίπου 110 pm.
Αιθένιο : Το μήκος του δεσμού C-H στο αιθένιο είναι περίπου 108 pm.
Συμπέρασμα
Τόσο το αιθάνιο όσο και το αιθένιο μπορούν να βρεθούν ως κύρια συστατικά στο φυσικό αέριο. Είναι πολύ εύφλεκτα και εύφλεκτα. Αν και το αιθένιο μπορεί να χρησιμοποιηθεί ως μονομερές για την παραγωγή πολυμερών, το αιθάνιο δεν μπορεί να χρησιμοποιηθεί για το σκοπό αυτό. Αυτό συμβαίνει επειδή το αιθάνιο δεν έχει ούτε διπλό δεσμό ούτε λειτουργική ομάδα. Αυτή είναι η κύρια διαφορά μεταξύ αιθανίου και αιθανίου.




