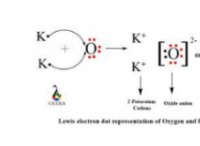
Τι εξαρτώνται οι χημικές ιδιότητες των ατόμων;
Οι ακόλουθοι παράγοντες επηρεάζουν τις χημικές ιδιότητες των ατόμων:
1. Ατομικός αριθμός: Ο ατομικός αριθμός ενός ατόμου καθορίζει τον αριθμό των πρωτονίων στον πυρήνα του. Ο αριθμός των πρωτονίων σε ένα άτομο καθορίζει επίσης τον αριθμό των ηλεκτρονίων που έχει το άτομο.
2. Διαμόρφωση ηλεκτρονίων: Η διαμόρφωση ηλεκτρονίων ενός ατόμου αναφέρεται στη διάταξη των ηλεκτρονίων του σε τροχιακά γύρω από τον πυρήνα. Η διαμόρφωση ηλεκτρονίων ενός ατόμου καθορίζει τις χημικές ιδιότητες του ατόμου.
3. ενέργεια ιονισμού: Η ενέργεια ιονισμού ενός ατόμου είναι η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από το άτομο. Η ενέργεια ιονισμού ενός ατόμου αυξάνεται καθώς ο αριθμός των πρωτονίων στον πυρήνα αυξάνεται. Αυτό σημαίνει ότι τα άτομα με υψηλότερες ενέργειες ιονισμού είναι λιγότερο πιθανό να χάσουν ηλεκτρόνια και να σχηματίσουν θετικά ιόντα.
4. συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων ενός ατόμου είναι η αλλαγή ενέργειας που συμβαίνει όταν ένα άτομο κερδίζει ένα ηλεκτρόνιο. Η συγγένεια ηλεκτρονίων ενός ατόμου αυξάνεται καθώς ο αριθμός των πρωτονίων στον πυρήνα αυξάνεται. Αυτό σημαίνει ότι τα άτομα με υψηλότερες συγγένειες ηλεκτρονίων είναι πιο πιθανό να κερδίσουν ηλεκτρόνια και να σχηματίσουν αρνητικά ιόντα.
5. Η ηλεκτροαρνητικότητα ενός ατόμου είναι ένα μέτρο της ικανότητάς του να προσελκύει ηλεκτρόνια. Η ηλεκτροαρνητικότητα αυξάνεται καθώς ο αριθμός των πρωτονίων στον πυρήνα αυξάνεται και καθώς ο αριθμός των ηλεκτρόνων σθένους μειώνεται.
Αυτοί οι παράγοντες καθορίζουν τον τρόπο με τον οποίο τα άτομα αλληλεπιδρούν μεταξύ τους για να σχηματίσουν χημικούς δεσμούς και ενώσεις. Με την κατανόηση αυτών των ιδιοτήτων, οι χημικοί μπορούν να προβλέψουν πώς θα συμπεριφέρονται τα άτομα σε διαφορετικές χημικές αντιδράσεις.