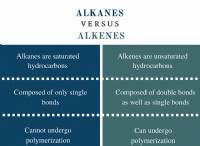
Τι πρέπει να γίνει για να αυξηθεί ο ρυθμός αντίδρασης;
1. Συγκέντρωση:
* Αύξηση της συγκέντρωσης αντιδραστηρίου: Περισσότερα μόρια αντιδραστηρίου σημαίνουν περισσότερες συγκρούσεις, οδηγώντας σε πιο επιτυχημένες συγκρούσεις και μια ταχύτερη αντίδραση.
* μείωση της συγκέντρωσης του προϊόντος: Η αφαίρεση των προϊόντων όπως σχηματίζονται μπορεί να μετατοπίσει την ισορροπία προς τον σχηματισμό προϊόντων, αυξάνοντας τον ρυθμό αντίδρασης.
2. Θερμοκρασία:
* αύξηση της θερμοκρασίας: Η θερμότητα παρέχει περισσότερη κινητική ενέργεια στα μόρια, καθιστώντας τα να κινούνται ταχύτερα και να συγκρούονται συχνότερα και με μεγαλύτερη δύναμη. Αυτό αυξάνει την πιθανότητα επιτυχημένων συγκρούσεων.
3. Επιφάνεια:
* Αύξηση της επιφάνειας: Για αντιδράσεις που περιλαμβάνουν στερεά, το σπάσιμο του στερεού σε μικρότερα κομμάτια εκθέτει περισσότερη επιφάνεια στα αντιδραστήρια, επιτρέποντας περισσότερες συγκρούσεις και ταχύτερη αντίδραση.
4. Καταλύτες:
* Προσθήκη καταλύτη: Οι καταλύτες παρέχουν μια εναλλακτική οδό αντίδρασης με χαμηλότερη ενέργεια ενεργοποίησης. Αυτό σημαίνει ότι περισσότερα μόρια μπορούν να ξεπεράσουν το ενεργειακό φράγμα και να αντιδράσουν, επιταχύνοντας την αντίδραση χωρίς να καταναλώνονται στη διαδικασία.
5. Πίεση:
* Αύξηση της πίεσης (για αέρια αντιδράσεις): Αυτό αυξάνει τη συγκέντρωση των αντιδραστηρίων, οδηγώντας σε συχνότερες συγκρούσεις.
6. Ανάδευση/ανάδευση:
* Αναταραχή του μίγματος της αντίδρασης: Αυτό βοηθά στη διανομή των αντιδραστηρίων ομοιόμορφα και να τους φέρει σε επαφή μεταξύ τους πιο αποτελεσματικά, αυξάνοντας τον ρυθμό αντίδρασης.
Παράδειγμα:
Φανταστείτε να καίνε ένα κομμάτι ξύλου. Δείτε πώς οι παραπάνω παράγοντες μπορούν να επηρεάσουν το ρυθμό καύσης:
* Συγκέντρωση: Περισσότερο οξυγόνο στον αέρα θα οδηγήσει σε ταχύτερη καύση.
* Θερμοκρασία: Μια υψηλότερη θερμοκρασία θα προκαλέσει το ξύλο να καεί πιο γρήγορα.
* επιφάνεια: Ένας σωρός από τσιπ ξύλου θα καεί ταχύτερα από ένα μόνο ημερολόγιο λόγω της αυξημένης επιφάνειας.
* Catalyst: Ένας καταλύτης όπως ένα μεταλλικό οξείδιο θα μπορούσε να επιταχύνει τη διαδικασία καύσης.
Σημαντική σημείωση: Όλοι οι παράγοντες δεν επηρεάζουν όλες τις αντιδράσεις με τον ίδιο τρόπο. Για παράδειγμα, η αύξηση της πίεσης θα αυξήσει γενικά τον ρυθμό των αντιδράσεων φάσης αερίου, αλλά μπορεί να έχει ελάχιστη επίδραση στις αντιδράσεις που περιλαμβάνουν υγρά ή στερεά.