Πώς χρησιμοποιούνται τα ηλεκτρόνια σθένους ενός ατόμου που χρησιμοποιείται για ταξινόμηση;
1. Χημικές ιδιότητες:
* Αντιδραστικότητα: Τα ηλεκτρόνια σθένους είναι τα εξώτατα ηλεκτρόνια και εμπλέκονται στη χημική σύνδεση. Τα άτομα με πλήρες εξωτερικό κέλυφος (8 ηλεκτρόνια σθένους) είναι σταθερά και μη αντιδραστικά (ευγενή αέρια). Τα άτομα με λιγότερα ηλεκτρόνια σθένους τείνουν να είναι αντιδραστικά, προσπαθώντας να κερδίσουν, να χάσουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση.
* Τύπος σύνδεσης: Ο αριθμός των ηλεκτρονίων σθένους υπαγορεύει τον τύπο των δεσμών που μπορεί να σχηματίσει ένα άτομο. Για παράδειγμα, τα μέταλλα με ηλεκτρόνια σθένους 1-3 τείνουν να σχηματίζουν ιοντικούς δεσμούς με την απώλεια ηλεκτρονίων, ενώ τα μη μέταλλα με ηλεκτρόνια 5-7 σθένους τείνουν να σχηματίζουν ομοιοπολικούς δεσμούς με την κοινή χρήση ηλεκτρονίων.
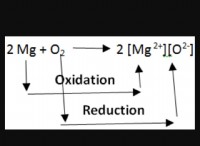
* καταστάσεις οξείδωσης: Τα ηλεκτρόνια σθένους καθορίζουν τις καταστάσεις οξείδωσης που μπορεί να αναλάβει ένα άτομο σε ενώσεις. Αυτό υποδεικνύει τον αριθμό των ηλεκτρονίων που ένα άτομο έχει κερδίσει, χαθεί ή μοιράζεται κατά τη διάρκεια του σχηματισμού ομολόγων.
2. Περιοδική ταξινόμηση πίνακα:
* Ομάδες (στήλες): Στοιχεία εντός της ίδιας ομάδας (κάθετη στήλη) του περιοδικού πίνακα έχουν τον ίδιο αριθμό ηλεκτρονίων σθένους. Αυτό εξηγεί γιατί τα στοιχεία της ίδιας ομάδας μοιράζονται παρόμοιες χημικές ιδιότητες.
* Περίοδοι (σειρές): Μετακίνηση σε μια περίοδο, ο αριθμός των ηλεκτρονίων σθένους αυξάνεται από αριστερά προς τα δεξιά. Αυτό αντιστοιχεί στην πλήρωση του εξωτερικού κελύφους ηλεκτρονίων, επηρεάζοντας τις ιδιότητες του ατόμου.
Συνοπτικά:
Ο αριθμός και η διαμόρφωση των ηλεκτρονίων σθένους παρέχουν βασικές γνώσεις σε ένα άτομο:
* Αντιδραστικότητα: Πόσο εύκολα σχηματίζει ομόλογα
* Τύπος σύνδεσης: ιοντικό, ομοιοπολικό ή μεταλλικό
* κατάσταση οξείδωσης: το δυναμικό του για κέρδος ή απώλεια ηλεκτρονίων
* Περιοδική θέση πίνακα: η ομάδα και η περίοδος του
Με την ανάλυση της δομής ηλεκτρονίων σθένους, οι χημικοί μπορούν να κατανοήσουν και να προβλέψουν τη συμπεριφορά των στοιχείων και τις αλληλεπιδράσεις τους για να σχηματίσουν ενώσεις.