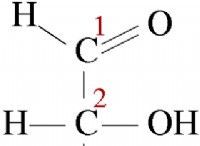
Πώς συνδυάζονται τα άτομα διαφορετικών στοιχείων;
1. Τύποι χημικών δεσμών
* Ιονική σύνδεση: Αυτό συνεπάγεται τη μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο. Ένα άτομο χάνει ηλεκτρόνια (καθιστώντας ένα θετικά φορτισμένο ιόν που ονομάζεται κατιόν) και ένα άλλο άτομο κερδίζει ηλεκτρόνια (καθιστώντας ένα αρνητικά φορτισμένο ιόν που ονομάζεται ανιόν). Αυτά τα αντίθετα φορτισμένα ιόντα στη συνέχεια προσελκύονται μεταξύ τους, σχηματίζοντας έναν ιοντικό δεσμό.
* Παράδειγμα:Το νάτριο (Na) χάνει ένα ηλεκτρόνιο για να γίνει Na+, και το χλώριο (CL) κερδίζει ένα ηλεκτρόνιο για να γίνει cl-. Αυτά τα ιόντα προσελκύουν το ένα το άλλο, σχηματίζοντας το χλωριούχο νάτριο ιοντικής ένωσης (NaCl), κοινώς γνωστό ως επιτραπέζιο αλάτι.
* ομοιοπολική σύνδεση: Αυτό συνεπάγεται την ανταλλαγή ηλεκτρονίων μεταξύ δύο ατόμων. Και τα δύο άτομα συμβάλλουν στα ηλεκτρόνια για να σχηματίσουν κοινά ζεύγη, δημιουργώντας έναν ισχυρό δεσμό μεταξύ τους.
* Παράδειγμα:Δύο άτομα υδρογόνου (Η) έχουν το καθένα ένα ηλεκτρόνιο. Μοιράζονται αυτά τα ηλεκτρόνια για να σχηματίσουν έναν ομοιοπολικό δεσμό, με αποτέλεσμα ένα μόριο αερίου υδρογόνου (H₂).
* Μεταλλική σύνδεση: Αυτό συμβαίνει σε μέταλλα, όπου τα ηλεκτρόνια κρατούνται χαλαρά από τα άτομα και μπορούν να κινούνται ελεύθερα σε όλο το μέταλλο. Αυτή η "θάλασσα" των ηλεκτρονίων δημιουργεί ισχυρά αξιοθέατα μεταξύ των μεταλλικών ατόμων, οδηγώντας στις χαρακτηριστικές τους ιδιότητες όπως η αγωγιμότητα και η ευελιξία.
* Παράδειγμα:Τα άτομα χαλκού (Cu) μοιράζονται τα ηλεκτρόνια τους, επιτρέποντάς τους να ρέουν ελεύθερα σε όλο το μέταλλο.
2. Παράγοντες που επηρεάζουν τη χημική σύνδεση
* Ηλεκτροργατιστικότητα: Αυτό είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια. Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ των ατόμων καθορίζει τον τύπο του δεσμού που θα σχηματιστεί.
* Μεγάλη διαφορά ηλεκτροαρνητικότητας =ιοντικός δεσμός
* Μικρή διαφορά ηλεκτροαρνητικότητας =ομοιοπολικός δεσμός
* ηλεκτρόνια σθένους: Ο αριθμός των ηλεκτρονίων στο εξώτατο κέλυφος ενός ατόμου καθορίζει την ικανότητα συγκόλλησής του. Τα άτομα τείνουν να συνδέονται με τρόπους που τους επιτρέπουν να κερδίσουν ένα πλήρες εξωτερικό κέλυφος.
3. Που αντιπροσωπεύουν χημικούς δεσμούς
* δομές Lewis: Αυτά τα διαγράμματα χρησιμοποιούν κουκκίδες για να αντιπροσωπεύουν ηλεκτρόνια και γραμμές σθένους για να αντιπροσωπεύουν κοινά ζεύγη ηλεκτρονίων σε ομοιοπολικούς δεσμούς.
* Χημικοί τύποι: Αυτά χρησιμοποιούν σύμβολα στοιχείων και δείκτες για να υποδείξουν τους τύπους και τους αριθμούς των ατόμων σε ένα μόριο ή ένωση.
Συνοπτικά: Τα άτομα συνδυάζονται για να επιτευχθούν σταθερότητα σχηματίζοντας χημικούς δεσμούς, είτε μέσω της μεταφοράς ηλεκτρονίων (ιοντικής σύνδεσης), της κατανομής των ηλεκτρονίων (ομοιοπολικής σύνδεσης), είτε της απομακρυσμένης θάλασσας των ηλεκτρονίων (μεταλλικός δεσμός). Ο συγκεκριμένος τύπος δεσμού εξαρτάται από τα ηλεκτρόνια και τα ηλεκτρόνια σθένους των εμπλεκόμενων ατόμων.