Πώς περιγράφονται τα στοιχεία από την άποψη των ατόμων;
1. Ατομικός αριθμός:
- Το καθοριστικό χαρακτηριστικό ενός στοιχείου είναι ο ατομικός αριθμός του , που αντιπροσωπεύει τον αριθμό των πρωτονίων στον πυρήνα ενός ατόμου.
- Όλα τα άτομα του ίδιου στοιχείου έχουν τον ίδιο ατομικό αριθμό.
- Για παράδειγμα, όλα τα άτομα άνθρακα έχουν ατομικό αριθμό 6, που σημαίνει ότι έχουν 6 πρωτόνια στον πυρήνα τους.
2. Ατομική μάζα:
- Η ατομική μάζα ενός στοιχείου είναι η μέση μάζα όλων των φυσικών ισοτόπων του.
- Τα ισότοπα είναι άτομα του ίδιου στοιχείου που έχουν τον ίδιο αριθμό πρωτονίων, αλλά διαφέρουν στον αριθμό των νετρονίων.
-Για παράδειγμα, ο άνθρακας έχει δύο κύρια ισότοπα:άνθρακα-12 (6 πρωτόνια, 6 νετρόνια) και άνθρακα-13 (6 πρωτόνια, 7 νετρόνια). Η ατομική μάζα άνθρακα είναι περίπου 12.011 μονάδες ατομικής μάζας (AMU), αντανακλώντας την αφθονία αυτών των ισοτόπων.
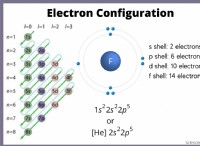
3. Διαμόρφωση ηλεκτρονίων:
- Η διαμόρφωση ηλεκτρονίων Περιγράφει τον τρόπο με τον οποίο τα ηλεκτρόνια είναι διατεταγμένα γύρω από τον πυρήνα ενός ατόμου.
- υπαγορεύει τις χημικές ιδιότητες ενός στοιχείου, καθώς τα ηλεκτρόνια στο εξωτερικό κέλυφος εμπλέκονται στη χημική σύνδεση.
- Κάθε στοιχείο έχει μια μοναδική διαμόρφωση ηλεκτρονίων.
4. Χημικές ιδιότητες:
- Τα στοιχεία χαρακτηρίζονται από χημικές ιδιότητες , που περιγράφουν τον τρόπο αλληλεπίδρασης με άλλα στοιχεία και ενώσεις.
- Αυτές οι ιδιότητες καθορίζονται από τη διαμόρφωση ηλεκτρονίων του ατόμου και την ικανότητά του να κερδίζει, να χάνει ή να μοιράζεται ηλεκτρόνια.
- Για παράδειγμα, το νάτριο είναι εξαιρετικά αντιδραστικό επειδή χάνει εύκολα το εξώτατο ηλεκτρόνιο του για να σχηματίσει ένα θετικό ιόν.
5. Φυσικές ιδιότητες:
- Τα στοιχεία έχουν επίσης διακριτικές φυσικές ιδιότητες , όπως πυκνότητα, σημείο τήξης, σημείο βρασμού και χρώμα.
- Αυτές οι ιδιότητες σχετίζονται με το μέγεθος του ατόμου, τη μάζα και τη δύναμη των δυνάμεων που συγκρατούν τα άτομα μαζί.
Συνοπτικά: Τα στοιχεία περιγράφονται από τις θεμελιώδεις ατομικές τους ιδιότητες, οι οποίες υπαγορεύουν τη χημική και φυσική τους συμπεριφορά. Η κατανόηση του ατόμου είναι ζωτικής σημασίας για την κατανόηση της φύσης και της συμπεριφοράς των στοιχείων.