Το χλωριούχο νάτριο είναι διαφορετικό από ένα μέταλλο ως ηλεκτρικός αγωγός;
μέταλλα:
* Μηχανισμός αγωγιμότητας: Τα μέταλλα διεξάγουν ηλεκτρική ενέργεια μέσω της κίνησης των ελεύθερων ηλεκτρονίων. Τα ηλεκτρόνια τους συνδέονται χαλαρά με τα άτομα και μπορούν εύκολα να μετακινηθούν σε όλο το υλικό.
* αγωγιμότητα: Τα μέταλλα είναι εξαιρετικοί αγωγοί ηλεκτρικής ενέργειας, ακόμη και σε θερμοκρασία δωματίου.
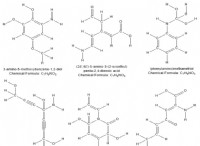
Χλωριούχο νάτριο (NaCl):
* Μηχανισμός αγωγιμότητας: Το χλωριούχο νάτριο είναι μια ιοντική ένωση. Στην στερεά του κατάσταση, έχει μια άκαμπτη δομή κρυσταλλικού πλέγματος με σταθερά θετικά και αρνητικά ιόντα (Na+ και Cl-) που συγκρατούνται από ισχυρές ηλεκτροστατικές δυνάμεις. Αυτά τα ιόντα δεν είναι ελεύθερα να κινηθούν, οπότε δεν διεξάγει ηλεκτρική ενέργεια.
* αγωγιμότητα: Το στερεό NaCl είναι ένας κακός αγωγός ηλεκτρικής ενέργειας. Ωστόσο, όταν διαλύεται σε νερό ή λιωμένο, γίνεται καλός αγωγός. Αυτό οφείλεται στο γεγονός ότι τα ιόντα γίνονται ελεύθερα να μετακινούνται και να φέρουν ηλεκτρικό φορτίο.
Βασικές διαφορές:
* Μηχανισμός αγωγιμότητας: Τα μέταλλα συμπεριφέρονται μέσω ελεύθερων ηλεκτρονίων, ενώ ιοντικές ενώσεις όπως η συμπεριφορά NaCl μέσω της κίνησης των ιόντων.
* κατάσταση ύλης: Τα μέταλλα είναι καλοί αγωγοί σε στερεά μορφή, ενώ το NaCl είναι μόνο αγώγιμο όταν διαλύεται ή λιωθεί.
Συνοπτικά: Ενώ τόσο τα μέταλλα όσο και οι ιοντικές ενώσεις όπως η NaCl μπορούν να διεξάγουν ηλεκτρική ενέργεια, οι μηχανισμοί και οι συνθήκες υπό τις οποίες διεξάγουν είναι πολύ διαφορετικές.