Τι αποτέλεσμα έχει ένα undered ζεύγος ηλεκτρονίων στο σχήμα ένα μόριο;
* Απομάκρυνση: Τα ζεύγη Lone ασκούν μια ισχυρότερη απωθητική δύναμη σε ζεύγη ηλεκτρονίων από τα ζεύγη συγκόλλησης που ασκούν το ένα το άλλο. Αυτό οφείλεται στο γεγονός ότι τα μοναχικά ζεύγη κρατούνται πιο κοντά στο κεντρικό άτομο και δεν μοιράζονται με άλλο άτομο.
* Παραμόρφωση γωνιών δεσμού: Η ισχυρότερη απόρριψη από τα ζεύγη Lone προωθεί τα ζεύγη συγκόλλησης περαιτέρω, οδηγώντας σε παραμόρφωση στις ιδανικές γωνίες δεσμών που αναμένονται από τη θεωρία VSEPR.
* Συνολικό μοριακό σχήμα: Η παρουσία και η θέση των μοναχικών ζευγών επηρεάζουν άμεσα το συνολικό σχήμα του μορίου.
Παραδείγματα:
* νερό (h₂o): Το οξυγόνο έχει δύο μοναχικά ζεύγη, τα οποία ωθούν τα δύο άτομα υδρογόνου πιο κοντά, με αποτέλεσμα μοριακή γεωμετρία σχήματος κηλίδας ή V.
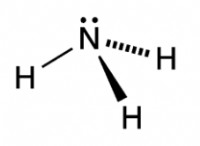
* αμμωνία (NH₃): Το άζωτο έχει ένα μοναδικό ζευγάρι, προκαλώντας τοποθετημένα τα τρία άτομα υδρογόνου σε ένα τριγωνικό πυραμιδικό σχήμα, και όχι σε ένα επίπεδο επίπεδη επίπεδη μορφή.
Συνοπτικά, ένα αδιευκρίνιστο ζεύγος ηλεκτρονίων προκαλεί:
* Αυξημένη απόρριψη
* Παραμόρφωση γωνιών δεσμού
* Τροποποιημένη μοριακή γεωμετρία
Η παρουσία μοναχικών ζευγών οδηγεί συχνά σε ένα πιο συμπαγές μοριακό σχήμα σε σύγκριση με τα μόρια με τον ίδιο αριθμό συνδεδεμένων ατόμων, αλλά κανένα μοναδικό ζευγάρι.