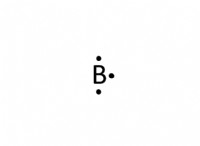Ποια είναι η κατάσταση οξείδωσης ενός ατομικού ατόμου θείου στο SO3;
1. Κατανοήστε τις καταστάσεις οξείδωσης
* Οι καταστάσεις οξείδωσης αντιπροσωπεύουν την υποθετική φόρτιση που θα είχε ένα άτομο εάν όλοι οι δεσμοί του ήταν 100% ιοντικοί.
* Εκχωρούνται με βάση τις διαφορές ηλεκτροαρνητικότητας.
* Το άθροισμα των καταστάσεων οξείδωσης σε ένα ουδέτερο μόριο πρέπει να είναι ίσο με μηδέν.
2. Εκχωρήστε καταστάσεις οξείδωσης
* οξυγόνο (o): Το οξυγόνο έχει συνήθως μια κατάσταση οξείδωσης -2, εκτός από τα υπεροξείδια (όπου είναι -1).
* θείο (s): Πρέπει να το καθορίσουμε.
3. Ρυθμίστε την εξίσωση
Αφήστε την κατάσταση οξείδωσης του θείου να είναι «Χ». Ο τύπος είναι SO3, δηλαδή:
(x) + 3 (-2) =0
4. Λύστε για x
* x - 6 =0
* x =+6
Επομένως, η κατάσταση οξείδωσης του θείου στο SO3 είναι +6.