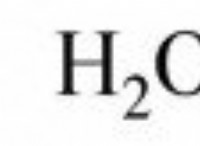Οι ιοντικοί δεσμοί μοιράζονται εξίσου ηλεκτρόνια;
Εδώ είναι γιατί:
* Οι ιονικοί δεσμοί σχηματίζονται μεταξύ ενός μετάλλου και ενός μη μέταλλου. Τα μέταλλα έχουν την τάση να χάσουν ηλεκτρόνια, να γίνονται θετικά φορτισμένα ιόντα (κατιόντα). Τα μη μέταλλα έχουν την τάση να κερδίζουν ηλεκτρόνια, να γίνονται αρνητικά φορτισμένα ιόντα (ανιόντα).
* Τα ηλεκτρόνια μεταφέρονται, δεν μοιράζονται. Το μεταλλικό άτομο ουσιαστικά "δωρίζει" ένα ή περισσότερα ηλεκτρόνια στο μη μέταλλο άτομο. Αυτό δημιουργεί μια ισχυρή ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων, η οποία συγκρατεί την ένωση μαζί.
* Η άνιση κοινή χρήση οδηγεί σε ηλεκτροστατική έλξη. Επειδή τα ηλεκτρόνια μεταφέρονται, τα προκύπτοντα ιόντα έχουν ένα ξεχωριστό θετικό και αρνητικό φορτίο. Αυτή η διαφορά στο φορτίο δημιουργεί μια ισχυρή ηλεκτροστατική έλξη που συγκρατεί τα ιόντα μαζί σε μια δομή κρυσταλλικού πλέγματος.
Παράδειγμα: Στο χλωριούχο νάτριο (NaCl), το νάτριο (Na) χάνει ένα ηλεκτρόνιο για να γίνει ένα θετικά φορτισμένο ιόν νατρίου (Na+), ενώ το χλώριο (CL) κερδίζει ένα ηλεκτρόνιο για να γίνει ένα αρνητικά φορτισμένο ιόν χλωριούχου (Cl-). Αυτά τα αντίθετα φορτισμένα ιόντα συγκρατούνται από την ισχυρή ηλεκτροστατική έλξη μεταξύ τους.
Σε αντίθεση με τους ιοντικούς δεσμούς, οι ομοιοπολικοί δεσμοί περιλαμβάνουν την ανταλλαγή ηλεκτρονίων μεταξύ δύο ατόμων. Σε καθαρά ομοιοπολικούς δεσμούς, τα ηλεκτρόνια μοιράζονται εξίσου. Ωστόσο, σε πολικούς ομοιοπολικούς δεσμούς, τα ηλεκτρόνια μοιράζονται άνισα λόγω διαφορών στην ηλεκτροαρνητικότητα μεταξύ των εμπλεκόμενων ατόμων.