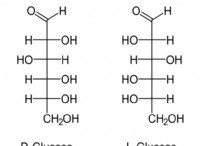
Ο χημικός δεσμός μεταξύ των δύο ατόμων είναι πιο πολικός;
Εδώ είναι γιατί:
* Διαφορά ηλεκτροαρνητικότητας: Το οξυγόνο έχει σημαντικά υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο (3,44 έναντι 2.20). Η ηλεκτροαρνητικότητα είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια σε έναν δεσμό. Αυτή η μεγάλη διαφορά σημαίνει ότι το οξυγόνο τραβά έντονα τα κοινά ηλεκτρόνια προς τον εαυτό του σε έναν δεσμό Ο-Η.
* Διπολική στιγμή: Η ανομοιογενής κατανομή των ηλεκτρονίων δημιουργεί ένα μερικό αρνητικό φορτίο (δ-) στο άτομο οξυγόνου και ένα μερικό θετικό φορτίο (Δ+) στο άτομο υδρογόνου. Αυτός ο διαχωρισμός του φορτίου σχηματίζει μια διπολική στιγμή, καθιστώντας τον δεσμό πολύ πολικό.
Άλλοι πολύ πολικοί δεσμοί:
Ενώ ο δεσμός H-O θεωρείται ο πιο πολικός, άλλοι δεσμοί με σημαντική πολικότητα περιλαμβάνουν:
* h-f: Το φθόριο είναι το πιο ηλεκτροαρνητικό στοιχείο.
* o-f: Τόσο το οξυγόνο όσο και το φθόριο είναι εξαιρετικά ηλεκτροαρνητικά.
Σημαντική σημείωση: Η πολικότητα ενός δεσμού επηρεάζει τις ιδιότητες του μορίου. Για παράδειγμα, οι πολικοί δεσμοί του νερού συμβάλλουν στο υψηλό σημείο βρασμού και στην ικανότητά του να διαλύουν πολλές ουσίες.