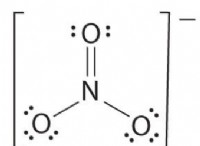
Ποια είναι η εξίσωση τύπου για το βουτάνιο;
Εδώ είναι μια κατανομή:
* C αντιπροσωπεύει άνθρακα
* h αντιπροσωπεύει υδρογόνο
* ₄ Υποδεικνύει ότι υπάρχουν τέσσερα άτομα άνθρακα σε κάθε μόριο βουτανίου
* ₁₀ Υποδεικνύει ότι υπάρχουν δέκα άτομα υδρογόνου σε κάθε μόριο βουτανίου
Είναι σημαντικό να σημειωθεί ότι το βουτάνιο μπορεί να υπάρχει σε δύο διαφορετικά ισομερή:
* n-butane (κανονικό βουτάνιο) :Τα τέσσερα άτομα άνθρακα είναι διατεταγμένα σε ευθεία αλυσίδα.
* Isobutane (2-μεθυλοπροπανίου) :Τρία άτομα άνθρακα βρίσκονται σε ευθεία αλυσίδα και το τέταρτο άτομο άνθρακα διακλαδίζεται από το δεύτερο άτομο άνθρακα.
Τόσο το Ν-βουτάνιο όσο και το ισοβουτάνιο έχουν τον ίδιο μοριακό τύπο (C₄H₁₀), αλλά οι δομές τους διαφέρουν ελαφρώς.