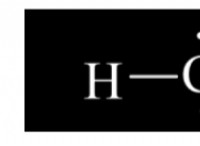
Ποια είναι η σταθερά ταχύτητας μιας αντίδρασης εάν 1 10 2 mol l s a m b 3 m και n 1;
Λείπει πληροφορίες:
* Νόμος για την τιμή: Έχετε δώσει τις συγκεντρώσεις των αντιδραστηρίων Α και Β, αλλά πρέπει να γνωρίζετε τον νόμο περί βαθμολογίας για αυτήν την αντίδραση. Ο νόμος του ποσοστού περιγράφει τον τρόπο με τον οποίο ο ρυθμός της αντίδρασης εξαρτάται από τις συγκεντρώσεις των αντιδραστηρίων. Συνήθως μοιάζει με αυτό:
`` `
Τιμή =k [a]^m [b]^n
`` `
* k είναι η σταθερά ρυθμού, κάτι που ψάχνετε.
* [a] και [b] είναι οι συγκεντρώσεις των αντιδραστηρίων Α και Β.
* m και n είναι οι εντολές της αντίδρασης σε σχέση με τα Α και Β, αντίστοιχα.
* Αρχικός ρυθμός: Πρέπει να γνωρίζετε τον αρχικό ρυθμό της αντίδρασης. Αυτός είναι ο ρυθμός στην αρχή της αντίδρασης, όταν οι συγκεντρώσεις των Α και Β βρίσκονται στις τιμές που δώσατε (1,1 x 10^2 mol/L για Α και 3 mol/L για Β).
Πώς να καθορίσετε τη σταθερά ρυθμού:
1. Λάβετε το νόμο του επιτοκίου: Μπορείτε είτε να σας δοθεί ο νόμος του επιτοκίου απευθείας είτε θα χρειαστεί να τον προσδιορίσετε πειραματικά με την εκτέλεση διαφορετικών πειραμάτων με ποικίλες συγκεντρώσεις αντιδραστηρίων και τη μέτρηση των αρχικών ρυθμών.
2. Μετρήστε τον αρχικό ρυθμό: Θα χρειαστεί να εκτελέσετε ένα πείραμα με τις δεδομένες συγκεντρώσεις Α και Β και να μετρήσετε τον αρχικό ρυθμό της αντίδρασης.
3. Συνδέστε τις τιμές: Μόλις έχετε τον νόμο του επιτοκίου και τον αρχικό επιτόκιο, μπορείτε απλά να συνδέσετε τις τιμές και να λύσετε τη σταθερά ρυθμού (k):
`` `
Τιμή =k [a]^m [b]^n
`` `
Λύστε για k:
`` `
k =ρυθμός / ([a]^m [b]^n)
`` `
Παράδειγμα:
Ας πούμε ότι ο νόμος του επιτοκίου είναι:
`` `
Τιμή =k [a]^1 [b]^2
`` `
Και μετρήσατε τον αρχικό ρυθμό να είναι 5 x 10^-3 mol/l · s.
Στη συνέχεια, μπορείτε να υπολογίσετε τη σταθερά ρυθμού:
`` `
k =(5 x 10^-3 mol/l · s)/((1,1 x 10^2 mol/l)^1 * (3 mol/l)^2)
`` `
`` `
k ≈ 4.5 x 10^-6 l^2/mol^2 · s
`` `
ΣΗΜΑΝΤΙΚΟ: Οι μονάδες της σταθεράς ρυθμού θα ποικίλλουν ανάλογα με τη συνολική σειρά της αντίδρασης (το άθροισμα των εκθέτων στο νόμο του επιτοκίου).