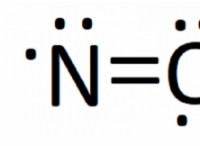Ποιο θα πρέπει να είναι μια ισχυρότερη βάση αμμωνίας ή αζώτου αζώτου;
* Ηλεκτροργατιστικότητα: Το φθόριο είναι το πιο ηλεκτροαρνητικό στοιχείο, που σημαίνει ότι τραβάει την πυκνότητα ηλεκτρονίων προς τον εαυτό του. Στο NF₃, τα εξαιρετικά ηλεκτροαρνητικά άτομα φθορίου τραβούν την πυκνότητα ηλεκτρονίων μακριά από το άτομο αζώτου, καθιστώντας λιγότερο πιθανό να δωρίσει το μοναδικό του ζευγάρι και να ενεργεί ως βάση.
* Επαγωγικό αποτέλεσμα: Η ισχυρή ηλεκτροαρνητικότητα του φθορίου στο NF₃ δημιουργεί μια σημαντική επαγωγική επίδραση. Αυτό το αποτέλεσμα αποσύρει την πυκνότητα ηλεκτρονίων από το άτομο αζώτου, μειώνοντας περαιτέρω τη βασικότητα του.
* Το μοναχικό ζευγάρι της αμμωνίας: Η αμμωνία έχει ένα μοναδικό ζεύγος ηλεκτρονίων στο άτομο αζώτου που είναι άμεσα διαθέσιμο για δωρεά, καθιστώντας την μια ισχυρή βάση Lewis.
Αντίθετα, το άτομο αζώτου στο NF₃ έχει πολύ χαμηλή πυκνότητα ηλεκτρονίων λόγω της ηλεκτροαρνητικότητας του φθορίου. Αυτό το καθιστά πολύ αδύναμη βάση.
Συνοπτικά:
* αμμωνία (NH₃): Ισχυρή βάση λόγω του εύκολα διαθέσιμου ζεύγους Lone.
* Τριφθορίδη αζώτου (NF₃): Πολύ αδύναμη βάση λόγω της ηλεκτροαρνητικότητας της πυκνότητας ηλεκτρονίων απόσυρσης φθορίου από το άτομο αζώτου.