Πώς βοηθά ο αριθμός των ηλεκτρόνων σθένους για να εξηγηθεί γιατί το αλουμίνιο είναι ένα βρώμιο μετάλλου και ιωδίου είναι μη μέταλλα;
ηλεκτρόνια και συγκόλληση:
* Electrons Salence είναι τα ηλεκτρόνια στο εξωτερικό κέλυφος ενός ατόμου. Αυτά τα ηλεκτρόνια εμπλέκονται στη χημική σύνδεση.
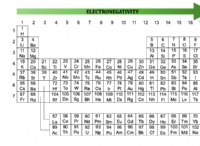
* μέταλλα τείνουν να έχουν χαμηλή ηλεκτροαρνητικότητα και λίγα ηλεκτρόνια σθένους (συνήθως 1, 2 ή 3). Αυτό σημαίνει ότι είναι πιο πιθανό να χάσουν αυτά τα ηλεκτρόνια σθένους για να σχηματίσουν θετικά ιόντα (κατιόντα).
* Μη μέταλλα έχουν υψηλή ηλεκτροαρνητικότητα και περισσότερα ηλεκτρόνια σθένους (συνήθως 4, 5, 6 ή 7). Είναι πιο πιθανό να κερδίσουν ηλεκτρόνια για να σχηματίσουν αρνητικά ιόντα (ανιόντα).
Εξηγώντας τη συμπεριφορά του αλουμινίου, του ιωδίου και του βρωμίου:
* αλουμίνιο (al): Το αλουμίνιο διαθέτει 3 ηλεκτρόνια σθένους. Χάνει εύκολα αυτά τα ηλεκτρόνια για να σχηματίσει ένα ιόν +3 (al³⁺). Αυτή η απώλεια ηλεκτρονίων δημιουργεί μια θάλασσα από αποσυνδεδεμένα ηλεκτρόνια που επιτρέπει τη μεταλλική συγκόλληση, η οποία είναι υπεύθυνη για τις χαρακτηριστικές ιδιότητες του αλουμινίου όπως η αγωγιμότητα και η ευελιξία.
* ιώδιο (i) και βρώμιο (br): Τόσο το ιώδιο όσο και το βρώμιο έχουν 7 ηλεκτρόνια σθένους. Τείνουν να κερδίζουν ένα ηλεκτρόνιο για να ολοκληρώσουν το οκτάδες τους και να σχηματίσουν αρνητικά ιόντα (i⁻ και Br⁻). Αυτή η τάση να κερδίζει ηλεκτρόνια και ιοντικά δεσμούς είναι χαρακτηριστική των μη-μετάλλων.
Συνοπτικά:
Ο αριθμός των ηλεκτρονίων σθένους επηρεάζει τον τρόπο με τον οποίο ένα στοιχείο αλληλεπιδρά με άλλα στοιχεία και καθορίζει τη μεταλλική ή μη μεταλλική συμπεριφορά του. Τα μέταλλα με λίγα ηλεκτρόνια σθένους χάνουν εύκολα ηλεκτρόνια για να σχηματίσουν κατιόντα, οδηγώντας σε μεταλλική συγκόλληση. Τα μη μέταλλα με περισσότερα ηλεκτρόνια σθένους κερδίζουν εύκολα ηλεκτρόνια για να σχηματίσουν ανιόντα, οδηγώντας σε ιοντική συγκόλληση.