Ποια είναι τα χαρακτηριστικά των χημικών δεσμών;
1. Δύναμη: Οι χημικοί δεσμοί ποικίλλουν σε ισχύ. Ορισμένοι δεσμοί είναι πολύ ισχυροί, όπως αυτοί που βρίσκονται στα μέταλλα, ενώ άλλοι είναι πιο αδύναμοι, όπως αυτοί που βρίσκονται σε δεσμούς υδρογόνου. Η αντοχή ενός δεσμού μετράται από την ενέργεια διάστασης των δεσμών, την ποσότητα ενέργειας που απαιτείται για να σπάσει ο δεσμός.
2. Κατευθυντικότητα: Ορισμένοι δεσμοί είναι κατευθυντικοί, που σημαίνει ότι έχουν συγκεκριμένο προσανατολισμό στο διάστημα. Για παράδειγμα, οι ομοιοπολικοί δεσμοί είναι κατευθυντικοί επειδή περιλαμβάνουν την ανταλλαγή ηλεκτρονίων μεταξύ συγκεκριμένων ατόμων. Άλλοι δεσμοί, όπως οι ιοντικοί δεσμοί, είναι μη κατευθυνόμενοι, που σημαίνει ότι δεν έχουν συγκεκριμένο προσανατολισμό στο διάστημα.
3. Πολικότητα: Οι χημικοί δεσμοί μπορούν να είναι πολικοί ή μη πολικοί. Οι πολικοί δεσμοί είναι αυτοί που έχουν ανομοιογενή κατανομή της πυκνότητας ηλεκτρονίων, οδηγώντας σε μερικές θετικές και αρνητικές χρεώσεις στα άτομα. Οι μη πολικοί δεσμοί έχουν ομοιόμορφη κατανομή της πυκνότητας ηλεκτρονίων.
4. Τύπος: Υπάρχουν διάφοροι τύποι χημικών δεσμών, όπως:
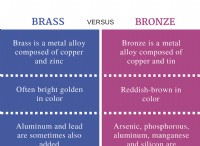
* Ιονικά ομόλογα: Σχηματίζεται από την ηλεκτροστατική έλξη μεταξύ των αντιθέτων ιόντων. Αυτοί οι δεσμοί συνήθως σχηματίζονται μεταξύ μετάλλων και μη μέταλλων.
* ομοιοπολικοί δεσμοί: Που σχηματίζονται από την κοινή χρήση ηλεκτρονίων μεταξύ των ατόμων. Αυτοί οι δεσμοί συνήθως σχηματίζονται μεταξύ των μη μεταλλικών.
* Μεταλλικοί δεσμοί: Σχηματίζεται από τη μετεγκατάσταση των ηλεκτρονίων μεταξύ ενός πλέγματος ατόμων μετάλλων. Αυτοί οι δεσμοί είναι υπεύθυνοι για τις μοναδικές ιδιότητες των μετάλλων, όπως η αγωγιμότητα και η ευελιξία τους.
* δεσμούς υδρογόνου: Αδύναμοι, κατευθυντικοί δεσμοί που σχηματίζονται μεταξύ ενός ατόμου υδρογόνου που συνδέονται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο ή το άζωτο) και ένα ζεύγος ηλεκτρονίων σε ένα παρακείμενο άτομο. Αυτοί οι δεσμοί διαδραματίζουν κρίσιμους ρόλους σε βιολογικά συστήματα, όπως η συγκράτηση των κλώνων DNA μαζί.
5. Μήκος ομολόγων: Αυτό αναφέρεται στη μέση απόσταση μεταξύ των πυρήνων δύο συνδεδεμένων ατόμων. Το μήκος του δεσμού είναι ένα μέτρο της αντοχής ενός χημικού δεσμού. Τα μικρότερα μήκη δεσμών υποδεικνύουν γενικά ισχυρότερους δεσμούς.
6. Παραγγελία ομολόγων: Αυτό αναφέρεται στον αριθμό των ζευγών ηλεκτρονίων που μοιράζονται μεταξύ δύο ατόμων. Είναι ένα μέτρο του αριθμού των ομοιοπολικών δεσμών μεταξύ δύο ατόμων.
7. Γωνία δεσμού: Αυτό αναφέρεται στη γωνία που σχηματίζεται από τους δεσμούς μεταξύ τριών ατόμων. Είναι ένα μέτρο του σχήματος ενός μορίου.
8. Σχηματισμός ομολόγων και σπάσιμο: Ο σχηματισμός χημικών δεσμών απελευθερώνει ενέργεια, ενώ το σπάσιμο των χημικών δεσμών απαιτεί εισροή ενέργειας. Αυτές οι διαδικασίες είναι απαραίτητες για τις χημικές αντιδράσεις και διέπονται από τις αρχές της θερμοδυναμικής.
Η κατανόηση αυτών των χαρακτηριστικών είναι ζωτικής σημασίας για την εξήγηση των ιδιοτήτων των ουσιών και την πρόβλεψη της συμπεριφοράς τους. Για παράδειγμα, η πολικότητα ενός μορίου επηρεάζει τη διαλυτότητα και την αντιδραστικότητα του. Η δύναμη των δεσμών επηρεάζει τα σημεία τήξης και βρασμού των ουσιών. Η κατανόηση των χημικών δεσμών αποτελεί ακρογωνιαίο λίθο της χημείας.