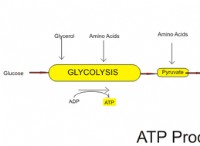
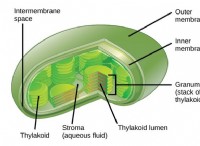
Ποιες είναι οι δύο ιδιότητες των τροχιακών στα οποία ενδιαφέρονται περισσότερο οι χημικοί;
1. Ενέργεια: Αυτή είναι η πιο θεμελιώδης ιδιοκτησία ενός τροχιακού. Καθορίζει πόση ενέργεια έχει ένα ηλεκτρόνιο σε αυτό το τροχιακό. Αυτό σχετίζεται άμεσα με το σχήμα και την απόσταση του τροχιακού από τον πυρήνα. Η ενέργεια των τροχιακών είναι ζωτικής σημασίας για την κατανόηση των χημικών αντιδράσεων, του σχηματισμού δεσμών και της σταθερότητας των μορίων.
2. Σχήμα: Αυτή η ιδιότητα περιγράφει τη χωρική κατανομή ενός ηλεκτρονίου σε ένα τροχιακό. Καθορίζει πώς κατανέμεται η πυκνότητα ηλεκτρονίων γύρω από τον πυρήνα. Το σχήμα των τροχιακών σχετίζεται άμεσα με τους τύπους των δεσμών που μπορεί να σχηματιστεί ένα άτομο και η γεωμετρία των μορίων. Για παράδειγμα, το σχήμα των τροχιακών S είναι σφαιρικό, ενώ τα τροχιακά P είναι σε σχήμα αλτήρα, γεγονός που επηρεάζει τον προσανατολισμό των δεσμών και τη συνολική μοριακή δομή.
Αυτές οι δύο ιδιότητες, ενέργεια και σχήμα, είναι θεμελιώδεις για την κατανόηση του τρόπου με τον οποίο τα ηλεκτρόνια συμπεριφέρονται σε άτομα και μόρια, τα οποία επιτρέπουν στους χημικούς να εξηγούν και να προβλέπουν χημικά φαινόμενα.