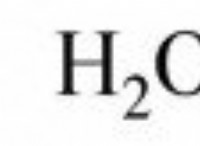Ποιος είναι ο αριθμός σθένους για το υδρογόνο;
Εδώ είναι γιατί:
* ηλεκτρόνια σθένους: Το υδρογόνο έχει μόνο ένα ηλεκτρόνιο στο εξωτερικό κέλυφος του.
* σταθερότητα: Για να επιτευχθεί μια σταθερή διαμόρφωση ηλεκτρονίων, το υδρογόνο πρέπει είτε να κερδίσει ένα ηλεκτρόνιο είτε να χάσει το μόνο ηλεκτρόνιο του.
* Ιονική σύνδεση: Όταν το υδρογόνο χάνει το ηλεκτρόνιο του, σχηματίζει ένα θετικά φορτισμένο ιόν (Η +) με σθένος +1.
* ομοιοπολική σύνδεση: Όταν το υδρογόνο μοιράζεται το ηλεκτρόνιο του με άλλο άτομο, έχει επίσης σθένος +1.
Έτσι, ανεξάρτητα από το αν το υδρογόνο σχηματίζει ένα ιοντικό ή ομοιοπολικό δεσμό, ο αριθμός σθένους του είναι πάντα +1.