Ποιες είναι οι τυπικές φυσικές ιδιότητες των ουσιών που έχουν μεταλλικούς ιοντικούς και ομοιοπολικούς δεσμούς;
Μεταλλική σύνδεση
* Ιδιότητες:
* καλοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας: Τα ηλεκτρόνια απομακρύνονται, επιτρέποντας την εύκολη κίνηση της φόρτισης.
* εύπλαστο και όλκιμο: Μπορεί να διαμορφωθεί και να τραβηχτεί σε καλώδια επειδή το μεταλλικό πλέγμα μπορεί εύκολα να παραμορφωθεί χωρίς να σπάσει.
* λαμπερό: Τα ηλεκτρόνια απορροφούν και επανασυνδέστε το φως, οδηγώντας σε μια λαμπερή εμφάνιση.
* υψηλά σημεία τήξης και βρασμού: Οι ισχυροί μεταλλικοί δεσμοί απαιτούν πολλή ενέργεια για να σπάσουν.
* Στερεά σε θερμοκρασία δωματίου (εκτός από τον υδράργυρο)
* αδιαφανές
* Παραδείγματα: Σίδηρος, χαλκός, χρυσός, αλουμίνιο
Ιονική σύνδεση
* Ιδιότητες:
* υψηλά σημεία τήξης και βρασμού: Τα ισχυρά ηλεκτροστατικά αξιοθέατα μεταξύ των ιόντων απαιτούν πολλή ενέργεια για να σπάσουν.
* εύθραυστο: Όταν εφαρμόζεται ένα άγχος, η μετατόπιση των ιόντων, οδηγώντας σε απωθητικές δυνάμεις και θραύσεις.
* Φτωχοί αγωγοί ηλεκτρικής ενέργειας στην στερεά κατάσταση, αλλά καλοί αγωγοί όταν λιωθούν ή διαλύονται σε νερό: Τα ιόντα κρατούνται σε ένα άκαμπτο πλέγμα στην στερεά κατάσταση, αλλά μπορούν να κινούνται ελεύθερα όταν λιωθεί ή διαλυθεί.
* Συχνά διαλυτό σε πολικούς διαλύτες όπως το νερό: Τα μόρια νερού μπορούν να αλληλεπιδρούν με τα φορτισμένα ιόντα.
* Κρυσταλλική δομή: Τα ιόντα σχηματίζουν ένα κανονικό, επαναλαμβανόμενο μοτίβο.
* Παραδείγματα: Χλωριούχο νάτριο (NaCl), οξείδιο μαγνησίου (MGO), ανθρακικό ασβέστιο (CACO3)
ομοιοπολική σύνδεση
* Ιδιότητες:
* ευρύ φάσμα σημείων τήξης και βρασμού: Μεταβαλλόμενη δύναμη των ομοιοπολικών δεσμών.
* μπορεί να είναι στερεό, υγρό ή αέριο σε θερμοκρασία δωματίου: Εξαρτάται από τη δύναμη των δεσμών και των διαμοριακών δυνάμεων.
* Γενικά φτωχοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας: Τα ηλεκτρόνια εντοπίζονται σε κοινά ζεύγη.
* συχνά έχουν χαμηλή διαλυτότητα στο νερό: Οι μη πολικές ομοιοπολικές ενώσεις δεν αλληλεπιδρούν έντονα με πολικά μόρια νερού.
* Μεταβλητή σκληρότητα και ευελιξία: Εξαρτάται από τη δομή και τη δύναμη των ομοιοπολικών δεσμών.
* Παραδείγματα: Νερό (H2O), μεθάνιο (CH4), Diamond (C), ζάχαρη (C12H22O11)
Σημαντικές σημειώσεις:
* Ενδιάμεση σύνδεση: Υπάρχουν πολλές ουσίες όπου η συγκόλληση δεν είναι καθαρά ένας τύπος, αλλά μάλλον ένας συνδυασμός διαφορετικών τύπων (π.χ. ομοιοπολική και ιοντική). Αυτές οι ουσίες μπορούν να παρουσιάσουν ιδιότητες που αποτελούν ένα μείγμα των χαρακτηριστικών που περιγράφονται παραπάνω.
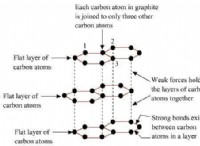
* Εξαιρέσεις: Υπάρχουν πάντα εξαιρέσεις από αυτές τις γενικές τάσεις. Για παράδειγμα, ο γραφίτης (μια μορφή καθαρού άνθρακα με ομοιοπολικούς δεσμούς) είναι ένας καλός αγωγός ηλεκτρικής ενέργειας λόγω της στρωμένης δομής του.
Επιτρέψτε μου να ξέρω αν θέλετε μια βαθύτερη κατάδυση σε οποιονδήποτε από αυτούς τους τύπους συγκόλλησης ή τις ιδιότητές τους!