Ποια μόρια έχουν πολικούς δεσμούς αλλά είναι μη πολικοί στη φύση;
Κατανόηση της πολικότητας
* πολικοί δεσμοί: Μορφή όταν δύο άτομα με διαφορετικές ηλεκτροναριτικότητες (ικανότητα προσέλκυσης ηλεκτρονίων) δεσμού. Αυτό δημιουργεί μια ανομοιογενή κοινή χρήση ηλεκτρονίων, με αποτέλεσμα ένα μερικό θετικό φορτίο (δ+) σε ένα άτομο και ένα μερικό αρνητικό φορτίο (δ-) από την άλλη.
* πολικά μόρια: Έχετε μια συνολική ανομοιόμορφη κατανομή της χρέωσης, δημιουργώντας μια διπολική στιγμή. Σκεφτείτε ένα φουσκωμένο teeter-totter-το μόριο είναι "κλίση".
* Μη πολικά μόρια: Έχουν ομοιόμορφη κατανομή της χρέωσης. Όπως ένα τέλεια ισορροπημένο teeter-totter, δεν υπάρχει συνολική κλίση.
Παραδείγματα μορίων με πολικούς δεσμούς αλλά μη πολική συνολικά:
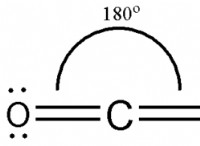
* διοξείδιο του άνθρακα (CO₂): Οι δεσμοί C =O είναι πολικοί επειδή το οξυγόνο είναι πιο ηλεκτροαρνητικό από τον άνθρακα. Ωστόσο, το γραμμικό σχήμα του μορίου σημαίνει ότι οι δύο πολικοί δεσμοί ακυρώνουν ο ένας τον άλλον. Φανταστείτε δύο άτομα που τραβούν ένα σχοινί με ίση δύναμη σε αντίθετες κατευθύνσεις - το σχοινί δεν κινείται!
* μεθάνιο (ch₄): Οι δεσμοί C-H είναι ελαφρώς πολικοί, αλλά το τετραεδρικό σχήμα του μορίου εξασφαλίζει ότι οι πολικότητες ακυρώνονται. Είναι σαν τέσσερα άτομα που τραβούν ένα σχοινί από διαφορετικές κατευθύνσεις με ίση δύναμη, διατηρώντας το σχοινί ακόμα.
* Tetrafluoroethylene (c₂f₄): Παρόμοια με το διοξείδιο του άνθρακα, το μόριο είναι επίπεδη και συμμετρική, με τους πολικούς δεσμούς C-F να ακυρώσουν ο ένας τον άλλον.
Key Takeaway:
Το σχήμα ενός μορίου είναι ζωτικής σημασίας για τον προσδιορισμό της συνολικής πολικότητάς του. Ακόμη και αν ένα μόριο έχει πολικούς δεσμούς, εάν το σχήμα επιτρέπει στις πολικότητες να ακυρώσουν ο ένας τον άλλον, θα είναι μη πολικό.