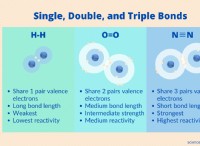
Γιατί τα ευγενή αέρια συνδυάζονται χημικά με άλλα στοιχεία;
Εδώ είναι γιατί:
* Διαμόρφωση ηλεκτρονίων: Τα ευγενή αέρια έχουν ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων, καθιστώντας τα εξαιρετικά σταθερά. Έχουν πλήρη οκτάδα (8 ηλεκτρόνια στο εξωτερικό κέλυφος) εκτός από το ήλιο, το οποίο έχει ένα ντουέτο (2 ηλεκτρόνια). Αυτή η σταθερή διάταξη σημαίνει ότι δεν έχουν καμία τάση να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια.
* Χαμηλή αντιδραστικότητα: Δεδομένου ότι δεν χρειάζεται να κερδίσουν ή να χάσουν ηλεκτρόνια για να γίνουν σταθερά, δεν σχηματίζουν εύκολα χημικούς δεσμούς με άλλα στοιχεία. Αυτό τους καθιστά πολύ αντιδραστικούς.
Εξαιρέσεις στον κανόνα:
Ενώ τα ευγενή αέρια είναι γενικά μη αντιδραστικά, υπάρχουν κάποιες εξαιρέσεις:
* Xenon και Krypton: Αυτά τα ευγενή αέρια είναι τα πιο αντιδραστικά και υπό συγκεκριμένες συνθήκες μπορούν να σχηματίσουν ενώσεις με φθόριο και οξυγόνο. Για παράδειγμα, το hexafluoride xenon (XEF6) και το διφθορίδιο Krypton (KRF2) είναι γνωστές ενώσεις.
* αργόν: Το Argon έχει παρατηρηθεί για να σχηματίσει μερικές ασταθείς ενώσεις, αλλά αυτές είναι πολύ σπάνιες.
Συνοπτικά: Η έλλειψη αντιδραστικότητας των ευγενών αερίων προέρχεται από τη σταθερή διαμόρφωση ηλεκτρονίων τους, γεγονός που τους καθιστά λιγότερο πιθανό να σχηματίσουν χημικούς δεσμούς με άλλα στοιχεία. Ωστόσο, υπάρχουν ορισμένες εξαιρέσεις, με βαρύτερα ευγενή αέρια όπως το Xenon και το Krypton που παρουσιάζουν κάποια αντιδραστικότητα υπό συγκεκριμένες συνθήκες.