Δομή CCl4 Lewis

Μια CCL4 Δομή Lewis είναι ένα διάγραμμα που αναπαριστά τη διαμόρφωση ηλεκτρονίων των ενώσεων με ομοιοπολικό δεσμό. Οι δομές Lewis προορίζονται να παρέχουν μια οπτικοποίηση της ατομικής δομής και της κατανομής των ηλεκτρονίων σε μια δεδομένη χημική ένωση.
Τετραχλωριούχος άνθρακας (CCl4 ) είναι μια ένωση ομοιοπολικού δεσμού που αποτελείται από έναν κεντρικό άνθρακα που περιβάλλεται από 4 άτομα χλωρίου σε τετραεδρική δομή. Το διάγραμμα Lewis από τον τετραχλωράνθρακα είναι:
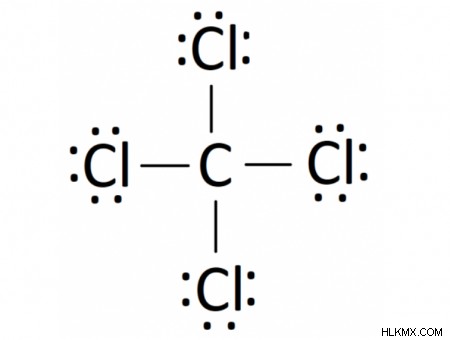
Ένα κανονικό άτομο άνθρακα έχει 4 μόνα ηλεκτρόνια στο εξωτερικό του περίβλημα. Το χλώριο έχει 7 ηλεκτρόνια και έτσι είναι λιγότερο 1 ηλεκτρόνιο για να γεμίσει πλήρως το εξωτερικό του περίβλημα. Έτσι, ένα άτομο άνθρακα θα μοιράζεται κάθε ένα από τα 4 εξωτερικά του ηλεκτρόνια με ένα μόνο άτομο χλωρίου, δίνοντας στα μεμονωμένα άτομα άνθρακα και στα 4 άτομα χλωρίου ένα πλήρες εξωτερικό περίβλημα ηλεκτρονίων. Στην προκύπτουσα ένωση, κάθε στοιχείο έχει επιτύχει μια σταθερή διαμόρφωση ηλεκτρονίων έχοντας 8 ηλεκτρόνια στο εξωτερικό του περίβλημα.
Δομές Lewis:Τα Βασικά
Οι δομές Lewis εισήχθησαν για πρώτη φορά από τον Αμερικανό χημικό G.N Lewis το 1916. Έκτοτε, έχουν γίνει πανταχού παρούσες στα μαθήματα χημείας σε επίπεδο γυμνασίου και πανεπιστημίου ως ένας εύκολος τρόπος κατανόησης των χημικών δεσμών.
Οι δομές Lewis προορίζονται να αντιπροσωπεύουν την ατομική και ηλεκτρονιακή δομή μιας χημικής ένωσης. Κάθε στοιχείο της ένωσης αντιπροσωπεύεται στη δομή Lewis από το χημικό του σύμβολο, άρα H για το υδρογόνο, C για τον άνθρακα, O για το οξυγόνο και ούτω καθεξής. Η διαμόρφωση του κελύφους ηλεκτρονίων του στοιχείου αντιπροσωπεύεται από ένα σχέδιο κουκκίδων που περιβάλλουν το χημικό σύμβολο. Τα κοινόχρηστα ζεύγη ηλεκτρονίων αντιπροσωπεύονται ως μια ενιαία γραμμή που συνδέει τα δύο συνδεδεμένα στοιχεία. Τα μεμονωμένα ζεύγη ηλεκτρονίων (ηλεκτρόνια που δεν συμμετέχουν σε χημικούς δεσμούς) αναπαρίστανται ως ζεύγος μοναχικών κουκκίδων δίπλα σε ένα χημικό σύμβολο.
Το πόσες τελείες υποτίθεται ότι βρίσκονται γύρω από ένα σύμβολο καθορίζεται από τον αριθμό σθένους του στοιχείου — τον αριθμό των ηλεκτρονίων στο εξωτερικό του περίβλημα. Το οξυγόνο, για παράδειγμα, έχει αριθμό σθένους 6 επειδή έχει 6 ηλεκτρόνια στο εξωτερικό του περίβλημα. Τα περισσότερα στοιχεία θα επιδιώξουν να γεμίσουν πλήρως το εξωτερικό τους περίβλημα και θα συνδεθούν με άλλα στοιχεία έως ότου ο αριθμός σθένους τους είναι 8, που αντιστοιχεί σε ένα πλήρες εξωτερικό περίβλημα 8 ηλεκτρονίων. Η τάση για τα στοιχεία των ενώσεων να διατάσσονται ώστε να έχουν ένα πλήρες φλοιό σθένους 8 ηλεκτρονίων ονομάζεται κανόνας οκτάδας . Η μόνη εξαίρεση στον κανόνα της οκτάδας είναι το υδρογόνο. Το υδρογόνο έχει ένα πλήρες εξωτερικό περίβλημα με μόνο 2 ηλεκτρόνια και έτσι θα σχηματίσει δεσμούς μέχρι να έχει 2 ηλεκτρόνια.
Έτσι, για παράδειγμα, νερό (H2 Ο) είναι μια χημική ένωση που αποτελείται από ένα μόνο άτομο οξυγόνου και δύο άτομα υδρογόνου. Το οξυγόνο έχει 6 ηλεκτρόνια σθένους και το υδρογόνο έχει 1 ηλεκτρόνιο σθένους. Το νερό σχηματίζεται από ένα άτομο οξυγόνου που μοιράζεται καθένα από τα δύο μονά του ηλεκτρόνια στο εξωτερικό περίβλημα με ένα μόνο ηλεκτρόνιο σε ένα άτομο υδρογόνου. Έτσι, η δομή Lewis του νερού μπορεί να αναπαρασταθεί ως:

Οι δύο συμπαγείς γραμμές που συνδέουν τα άτομα υδρογόνου με τα άτομα οξυγόνου αντιπροσωπεύουν τα κοινά ζεύγη ηλεκτρονίων μεταξύ τους και τα δύο ζεύγη μονών κουκκίδων αντιπροσωπεύουν τα μόνα ζεύγη ηλεκτρονίων στο άτομο οξυγόνου. Ο αριθμός σθένους του υδρογόνου είναι 1 και ο αριθμός σθένους του οξυγόνου είναι 6, οπότε αν τα αθροίσουμε μαζί μας δίνουμε 1(2)+1(6)=8. Άρα το διάγραμμά μας έχει 8 συνολικά ηλεκτρόνια.
Κανόνες για την κατασκευή δομών Lewis
Οι δομές Lewis είναι ένα απίστευτα χρήσιμο εργαλείο για τον προσδιορισμό της οργάνωσης των συστατικών μιας ένωσης. Μπορείτε να κατασκευάσετε ένα διάγραμμα Lewis για μια χημική ένωση ακολουθώντας αυτά τα βήματα:
Βήμα 1. Προσδιορίστε τον συνολικό αριθμό ηλεκτρονίων σθένους στο διάγραμμα.
Ο συνολικός αριθμός ηλεκτρονίων σθένους σε ένα διάγραμμα Lewis είναι ίσος με το άθροισμα των αριθμών σθένους των μεμονωμένων στοιχείων που συνθέτουν την ένωση. Χρήση CCl4 όπως το παράδειγμά μας, ο συνολικός αριθμός ηλεκτρονίων στο διάγραμμά μας είναι ίσος με το άθροισμα του αριθμού σθένους του άνθρακα και του αριθμού σθένους για κάθε άτομο χλωρίου. Ο άνθρακας έχει αριθμό σθένους 4 και κάθε ένα από τα τέσσερα άτομα χλωρίου έχει αριθμό σθένους 7. Άρα ο συνολικός αριθμός ηλεκτρονίων στο διάγραμμά μας CCl4 θα πρέπει να είναι:
1(4)+4(7) = 32 ηλεκτρόνια .
Βήμα 2. Σχεδιάστε ένα σκελετό της ατομικής δομής της ένωσης.
Επόμενο είναι να καταλάβουμε την ατομική οργάνωση της ένωσης. Εάν η ένωση είναι διατομική (αποτελούμενη από μόνο δύο άτομα), τότε αυτό είναι εύκολο:η ατομική δομή θα είναι απλώς τα δύο άτομα που κάθονται το ένα δίπλα στο άλλο σε ευθεία γραμμή. Σε μια ένωση με τρία ή περισσότερα άτομα, τα πράγματα γίνονται λίγο πιο περίπλοκα. Στις περισσότερες ενώσεις με περισσότερα από τρία άτομα, τείνει να υπάρχει ένα κεντρικό άτομο (ή άτομα) που μοιράζεται δεσμούς με πολλαπλά άτομα. Το κεντρικό άτομο(α) τείνει να είναι το λιγότερο ηλεκτραρνητικό στοιχείο της ένωσης.
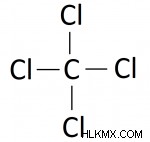
Στην περίπτωσή μας, ο άνθρακας είναι λιγότερο ηλεκτραρνητικός από το χλώριο, επομένως ο άνθρακας είναι το κεντρικό άτομο. Μπορούμε να σχεδιάσουμε το διάγραμμά μας με ένα κεντρικό άτομο άνθρακα που περιβάλλεται από 4 άτομα χλωρίου, ως εξής:

Βήμα 3. Τοποθετήστε έναν απλό δεσμό μεταξύ κάθε συνδεδεμένου ζεύγους ατόμων.
Τώρα ήρθε η ώρα να συμπληρώσετε το διάγραμμα με ηλεκτρόνια. Θυμηθείτε ότι μια μεμονωμένη γραμμή αντιπροσωπεύει ένα κοινό ζεύγος ηλεκτρονίων. Τα άτομα σχηματίζουν ομοιοπολικές ενώσεις μοιράζοντας ηλεκτρόνια, επομένως κάθε άτομο πρέπει να μοιράζεται τουλάχιστον ένα ζεύγος ηλεκτρονίων με ένα άλλο άτομο. Η προσθήκη ενός μόνο δεσμού σε κάθε άτομο στο προηγούμενο διάγραμμα μας δίνει:
Δεδομένου ότι κάθε γραμμή μετράει για δύο ηλεκτρόνια, χρησιμοποιήσαμε 8 ηλεκτρόνια. Αυτό σημαίνει ότι έχουμε ακόμα 32−8= 24 ηλεκτρόνια αφήνεται για να τοποθετηθεί στο διάγραμμα.
Βήμα 4. Ξεκινώντας με τα εξωτερικά άτομα, συμπληρώστε ζεύγη ηλεκτρονίων έως ότου κάθε εξωτερικό άτομο να ικανοποιήσει τον κανόνα της οκτάδας (εκτός από το υδρογόνο, που παίρνει 2).
Τα άτομα επιδιώκουν να γεμίσουν το εξωτερικό τους περίβλημα με ηλεκτρόνια, έτσι θα προσπαθήσουν να το κάνουν πριν σχηματίσουν άλλους δεσμούς. Συμπληρώστε το διάγραμμα με ζεύγη ηλεκτρονίων (κουκκίδες) μέχρι κάθε τερματικό άτομο να περιβάλλεται από 8 άτομα. Θυμηθείτε ότι τα κοινόχρηστα ζεύγη ατόμων υπολογίζονται στον συνολικό αριθμό ηλεκτρονίων σθένους για κάθε άτομο. Συμπληρώνοντας το διάγραμμα μας δίνουμε:
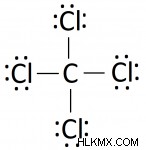
Εφόσον μόλις τοποθετήσαμε 12 ζεύγη ηλεκτρονίων έχουμε 24−12(2) = 0 ηλεκτρόνια αφήνεται στη θέση. Τα τοποθετήσαμε όλα!
Βήμα 5. Εάν παραμένουν ζεύγη ηλεκτρονίων, τοποθετήστε τα δίπλα στο κεντρικό άτομο μέχρι να γεμίσει
Μόλις τα τερματικά άτομα αποκτήσουν μια πλήρη οκτάδα, τυχόν επιπλέον ηλεκτρόνια δεν έχουν πού αλλού να πάνε παρά να επιστρέψουν στο κεντρικό άτομο. Τοποθετήστε τυχόν ζεύγη ηλεκτρονίων που έχουν απομείνει γύρω από το κεντρικό άτομο έως ότου το κεντρικό άτομο αποκτήσει μια πλήρη οκτάδα. Αυτά τα ζεύγη θα υπάρχουν ως μοναχικά ζεύγη που παραμένουν αδέσμευτα.
Στην περίπτωσή μας, δεν έχουμε εναπομείναν ηλεκτρόνια και κάθε άτομο στο διάγραμμά μας ικανοποιεί τον κανόνα της οκτάδας.
Βήμα 6. Εάν το κεντρικό άτομο εξακολουθεί να μην έχει πλήρες εξωτερικό περίβλημα, μετακινήστε τα υπάρχοντα ζεύγη ηλεκτρονίων μαζί για να σχηματίσουν ένα διπλό ή τριπλό ομόλογο.
Εάν όλα τα τερματικά άτομα έχουν πλήρες κέλυφος, δεν υπάρχουν άλλα εφεδρικά ζεύγη ηλεκτρονίων για να τοποθετηθούν και το κεντρικό άτομο ακόμα δεν έχει πλήρες εξωτερικό κέλυφος, τα άτομα πρέπει να γίνουν λίγο δημιουργικά. Τα υπάρχοντα ζεύγη ηλεκτρονίων από τα τερματικά άτομα θα κινηθούν και θα ενώσουν κοινά ζεύγη ηλεκτρονίων για να σχηματίσουν διπλούς ή τριπλούς δεσμούς. Ένας διπλός δεσμός είναι ουσιαστικά το τερματικό άτομο και το κεντρικό άτομο που μοιράζονται 4 ηλεκτρόνια, 6 για τριπλούς δεσμούς. Οι διπλοί δεσμοί αντιπροσωπεύονται με διπλή γραμμή (=) ή τριπλή γραμμή (≡).
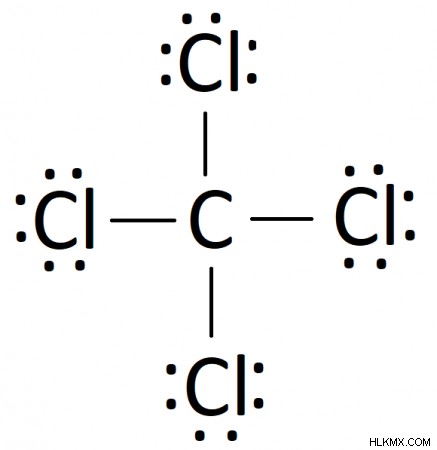
Ακολουθώντας αυτά τα βήματα, μπορείτε να κατασκευάσετε ένα διάγραμμα Lewis για έναν αριθμό ομοιοπολικών ενώσεων. Στην περίπτωσή μας, το τελικό διάγραμμα Lewis για CCl4 είναι:
Περιορισμοί των διαγραμμάτων Lewis
Τα διαγράμματα Lewis είναι χρήσιμα και αρκετά ακριβή για τον προσδιορισμό της διαμόρφωσης ηλεκτρονίων ενώσεων που αποτελούνται από στοιχεία κύριας ομάδας, αλλά έχουν κάποιες ελλείψεις. Δεν ακολουθεί κάθε χημική ένωση τους ακριβείς κανόνες συγκόλλησης που περιγράφονται παραπάνω. Όπως με κάθε κανόνα, υπάρχουν και εξαιρέσεις. Τα μέταλλα μετάπτωσης, για παράδειγμα, συχνά δεν ακολουθούν τον κανόνα της οκτάδας και αντ' αυτού γεμίζουν το εξωτερικό τους περίβλημα με 12 ηλεκτρόνια. Για ορισμένες ενώσεις, δεν υπάρχει ένα κατάλληλο διάγραμμα, επομένως η διαμόρφωση ηλεκτρονίων αυτών των ενώσεων περιγράφεται ως ένα υβρίδιο πολλαπλών διαγραμμάτων Lewis. Αυτές ονομάζονται δομές συντονισμού .
Τα διαγράμματα Lewis δεν δίνουν επίσης πολλές πληροφορίες σχετικά με τον τρισδιάστατο γεωμετρικό προσανατολισμό των ατόμων, ο οποίος είναι σημαντικός για την εξήγηση της πολικότητας και της συμπεριφοράς διαμοριακών δεσμών των ενώσεων. Η θεωρία VESPR είναι μια μέθοδος χημικής μοντελοποίησης που περιγράφει το τρισδιάστατο σχήμα ενός μορίου και πώς αυτό το σχήμα προκύπτει από την ηλεκτροστατική απώθηση ζευγών ηλεκτρονίων. Τα ηλεκτρόνια απωθούν το ένα το άλλο, έτσι ένα μόριο τείνει να πάρει ένα σχήμα που ελαχιστοποιεί την απώθηση μεταξύ των ζευγών ηλεκτρονίων. Αυτές οι πληροφορίες μπορούν να χρησιμοποιηθούν για την πρόβλεψη της πιθανής γεωμετρικής δομής μιας δεδομένης ένωσης.
Επιπλέον, τα διαγράμματα Lewis δεν εξηγούν γιατί ή πώς τα ηλεκτρόνια σχηματίζουν τους δεσμούς που κάνουν. Αυτό είναι ένα ερώτημα που επαφίεται στη μοριακή τροχιακή θεωρία (θεωρία MO), μια μαθηματική τεχνική που περιγράφει πώς συνδυάζονται τα τροχιακά ηλεκτρονίων χάρη στις κυματοειδείς ιδιότητες των ηλεκτρονίων.
Συνοπτικά, τα διαγράμματα Lewis είναι ένας χρήσιμος και απλός τρόπος για να περιγραφεί η διαμόρφωση ηλεκτρονίων των ενώσεων με ομοιοπολικό δεσμό. Ένα διάγραμμα Lewis μπορεί να σας πει πώς κατανέμονται τα ηλεκτρόνια σε μια ένωση και μπορεί να χρησιμοποιηθεί για την πρόβλεψη αυτής της κατανομής. Τα διαγράμματα Lewis είναι εύκολο να κατασκευαστούν και μπορούν να γίνουν ακολουθώντας ένα απλό σύνολο κανόνων. Οι δομές Lewis των περισσότερων ενώσεων που σχηματίζονται από στοιχεία κύριας ομάδας από περιόδους 2–7 μπορούν να κατασκευαστούν ακολουθώντας το παραπάνω σύνολο κανόνων.




