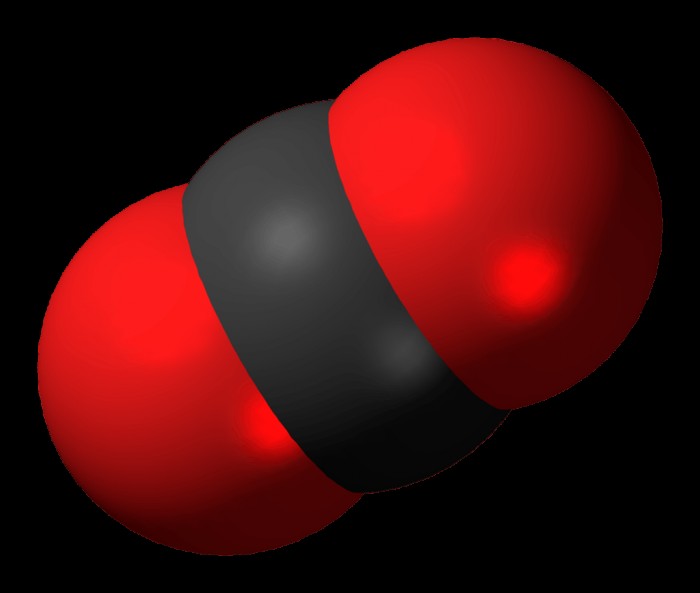
CO2 (διοξείδιο του άνθρακα) Lewis Dot Structure

Η Δομή Lewis Dot γιαδιοξείδιο του άνθρακα μπορεί να αναπαρασταθεί ως εξής:
o=C=o
Αλλά τι ακριβώς σημαίνει αυτό; Τι είναι η δομή Lewis Dot και τι αντιπροσωπεύουν τα σύμβολα στη δομή του διοξειδίου του άνθρακα; Ας δούμε τη δομή Lewis και ας μάθουμε πώς να ερμηνεύσουμε αυτήν την αναπαράσταση του διοξειδίου του άνθρακα.
Πώς να διαβάσετε μια δομή Lewis Dot
Η δομή κουκκίδων Lewis σχεδιάζεται με γράμματα που αντιπροσωπεύουν τα άτομα του στοιχείου και, στη συνέχεια, με έναν αριθμό κουκκίδων ή παύλων που περιβάλλουν αυτά τα γράμματα. Οι τελείες μπορούν να χρησιμοποιηθούν για να αναπαραστήσουν τα κοινά ηλεκτρόνια μέσα στους δεσμούς των ατόμων, αλλά οι παύλες μπορούν επίσης να χρησιμοποιηθούν για να αναπαραστήσουν ομοιοπολικούς δεσμούς. Μεμονωμένα ζεύγη ηλεκτρονίων εμφανίζονται γύρω από τα άτομα με τελείες και οι διπλοί δεσμοί αντιπροσωπεύονται με διπλές γραμμές αντί για τις απλές γραμμές που συνήθως ενώνουν τα άτομα μεταξύ τους στο μόριο.
Δημιουργία δομής Lewis Dot


Η δομή Lewis Dot είναι μια γραφική αναπαράσταση του τρόπου με τον οποίο τα ηλεκτρόνια κατανέμονται γύρω από τα άτομα που αποτελούν ένα μόριο. Ο λόγος για τη σχεδίαση/δημιουργία μιας δομής κουκκίδας Lewis είναι ότι βοηθάει κάποιον να προβλέψει τα είδη των δεσμών, καθώς και έναν αριθμό δεσμών, που μπορούν να σχηματιστούν γύρω από ένα άτομο. Οι δομές Lewis μπορούν να χρησιμοποιηθούν για να γίνουν προβλέψεις σχετικά με τη διάταξη ενός μορίου. Αν και μια δομή Lewis μπορεί να φαίνεται τρομακτική με την πρώτη ματιά, είναι στην πραγματικότητα αρκετά εύκολο να κατανοήσετε μια δομή Lewis και να τη σχεδιάσετε μόνοι σας, εάν αναλύσετε τη δημιουργία της δομής Lewis σε απλά βήματα.
Το πρώτο βήμα για τη σχεδίαση μιας δομής Lewis είναι να προσδιοριστεί πόσα ηλεκτρόνια σθένους έχει συνολικά το μόριο. Αυτό περιλαμβάνει την καταμέτρηση όλων των ηλεκτρονίων σθένους στο μόριο. Τα ηλεκτρόνια σθένους είναι το ηλεκτρόνιο που διαθέτει το άτομο στο κέλυφος σθένους ή το εξωτερικό περίβλημα του ατόμου. Τα άτομα έχουν διαφορετικά κελύφη ή στρώματα και καθένα από αυτά τα στρώματα έχει τα δικά του ηλεκτρόνια. Ωστόσο, στη χημεία, τυπικά μόνο τα ηλεκτρόνια εντός του φλοιού σθένους μπορούν να συμμετέχουν στο σχηματισμό ενός χημικού δεσμού. Δεδομένου ότι τα ηλεκτρόνια στο περίβλημα του σθένους είναι τα ηλεκτρόνια που θα σχηματίσουν δεσμούς με άλλα άτομα για να δημιουργήσουν μόρια, είναι σημαντικό να γνωρίζουμε τον αριθμό των ηλεκτρονίων σθένους για να σχεδιάσουμε ένα διάγραμμα δομής Lewis.
Στο δεύτερο μέρος της σχεδίασης ενός διαγράμματος κουκκίδων Lewis, πρέπει να προσδιοριστεί ο αριθμός των ηλεκτρονίων που απαιτούνται για να γίνει το άτομο ικανοποιημένο ή «ευτυχισμένο». Με άλλα λόγια, πρέπει να βρεθεί ο αριθμός των ατόμων που απαιτούνται για να γεμίσει το εξωτερικό κέλυφος ηλεκτρονίων του ατόμου. Όταν το εξωτερικό κέλυφος ηλεκτρονίων του ατόμου είναι σε χωρητικότητα, θεωρείται «ευτυχισμένο» και δεν θέλει άλλα ηλεκτρόνια στο εξωτερικό περίβλημα. Ένας καλός ευρετικός που μπορεί να ακολουθήσει κανείς για να μάθει πόσα ηλεκτρόνια χρειάζεται ένα άτομο ενός στοιχείου είναι ο «κανόνας της οκτάδας». Ο κανόνας της οκτάδας αναφέρεται στο γεγονός ότι τα στοιχεία μέχρι εκείνα που βρέθηκαν στην περίοδο τέσσερα στον πίνακα περιόδου απαιτούν οκτώ ηλεκτρόνια στη στιβάδα σθένους τους για να ικανοποιηθούν.
Το βήμα 3 της δημιουργίας μιας δομής Lewis είναι ο καθορισμός πόσους δεσμούς διαθέτει το μόριο συνολικά. Οι ομοιοπολικοί δεσμοί δημιουργούνται όταν ένα ηλεκτρόνιο από το ένα άτομο ενώνεται με ένα ηλεκτρόνιο από το άλλο άτομο, σχηματίζοντας ένα ζεύγος ηλεκτρονίων. Στο βήμα 2 προσδιορίστηκε ο αριθμός των ηλεκτρονίων που απαιτούνται για τη δημιουργία ενός δεσμού, ενώ στο βήμα 1 προσδιορίστηκε ο αριθμός των ηλεκτρονίων που υπάρχουν στο κέλυφος σθένους. Προκειμένου να προσδιοριστεί ο αριθμός των δεσμών μέσα στο μόριο, ο συνολικός αριθμός ηλεκτρονίων σθένους πρέπει να αφαιρεθεί από τον αριθμό των ηλεκτρονίων που χρειάζονται για να γεμίσουν το εξωτερικό περίβλημα του ατόμου. Κάνοντας αυτό θα σας δώσει τον απαιτούμενο αριθμό ατόμων που χρειάζονται για να ολοκληρώσετε τις οκτάδες. Δεδομένου ότι κάθε δεσμός απαιτεί δύο ηλεκτρόνια, ο αριθμός των δεσμών υπολογίζεται διαιρώντας τον αριθμό των ηλεκτρονίων στο μισό.
Το βήμα 4 της δημιουργίας μιας δομής κουκίδων Lewis είναι η επιλογή ενός κεντρικού ατόμου από το οποίο θα διακλαδιστούν τα άλλα άτομα στο διάγραμμα. Το κεντρικό άτομο ενός μορίου είναι συνήθως το άτομο με το υψηλότερο ηλεκτρονιακό σθένος του ατόμου με το χαμηλότερο επίπεδο ηλεκτραρνητικότητας. Ο προσδιορισμός της ηλεκτραρνητικότητας ενός ατόμου μπορεί να γίνει συμβουλευόμενος έναν πίνακα που παραθέτει συγκεκριμένες τιμές ή χρησιμοποιώντας την τάση ηλεκτραρνητικότητας του περιοδικού πίνακα για τον προσδιορισμό της τιμής. Η τάση ηλεκτραρνητικότητας αναφέρεται στο γεγονός ότι γενικά η ηλεκτραρνητικότητα μειώνεται καθώς κάποιος κινείται προς τα κάτω στον περιοδικό πίνακα, ακολουθώντας μια ομάδα προς τα κάτω, ενώ τείνει να αυξάνεται καθώς διαβάζει κανείς στον πίνακα από αριστερά προς τα δεξιά. Τα άτομα αλογόνου, καθώς και τα άτομα υδρογόνου, εμφανίζονται συνήθως στο εξωτερικό του μορίου και για αυτόν τον λόγο, συνήθως δεν επιλέγονται ως το κεντρικό άτομο.
Αφού επιλέξετε ένα κεντρικό άτομο, το επόμενο βήμα είναι να σχεδιάσετε μια σκελετική δομή. Πρέπει να σχεδιάσετε το κεντρικό άτομο και στη συνέχεια να συνδέσετε τα άλλα άτομα με το κεντρικό άτομο σχεδιάζοντας ευθείες γραμμές που συνδέουν τα άτομα μεταξύ τους. Το κεντρικό άτομο ενός μορίου μπορεί να ενωθεί με έως και τέσσερα άλλα άτομα.
Αφού σχεδιάσουμε τα άτομα και τις μεταξύ τους συνδέσεις, τα ηλεκτρόνια πρέπει να τοποθετηθούν γύρω από τα άτομα, σχεδιασμένα εξωτερικά. Οι οκτάδες πρέπει να συμπληρώνονται στο εξωτερικό των ατόμων. Δεδομένου ότι το εξωτερικό των ατόμων χρειάζεται πλήρεις οκτάδες, εάν ανακαλυφθεί ότι δεν υπάρχουν αρκετά ηλεκτρόνια, τότε αυτό σημαίνει ότι η σκελετική δομή που σχεδιάστηκε στο βήμα 5 έχει ακατάλληλη ευθυγράμμιση. Κάποιες δοκιμές και λάθη μπορεί να χρειαστούν αρχικά για να βρεθεί η σωστή δομή, αν και με την πρακτική αυτό θα γίνει ευκολότερο.
Τέλος, τα άλλα ηλεκτρόνια που δεν έχουν χρησιμοποιηθεί θα πρέπει να τοποθετηθούν γύρω από το κεντρικό άτομο. Μόλις ολοκληρωθεί η οκτάδα του κεντρικού ατόμου, τυχόν δεσμοί που έχουν απομείνει θα πρέπει να χρησιμοποιηθούν για τη δημιουργία διπλών δεσμών, οι οποίοι αντιπροσωπεύονται από δύο ευθείες παράλληλες γραμμές, αντί για μία μόνο γραμμή. Μπορείτε να καταλάβετε εάν ο αριθμός των ατόμων μετρήθηκε εσφαλμένα στο Βήμα 1, εάν το κεντρικό άτομο έχει περισσότερα από οκτώ ηλεκτρόνια και το άτομο δεν είναι μία από τις σημειωμένες εξαιρέσεις στον κανόνα της οκτάδας.
Πώς διαφέρουν οι δομές Lewis από τα πραγματικά μόρια;
Οι δομές Lewis είναι χρήσιμα μοντέλα που διευκολύνουν την κατανόηση της δομής των ατόμων. Ωστόσο, όπως όλα τα μοντέλα απαιτείται κάποια απλοποίηση/αφαίρεση. Επομένως, υπάρχουν ορισμένες διαφορές μεταξύ των πραγματικών μορίων και των δομών Lewis που πρέπει να σημειωθούν.
Ένας από τους τρόπους με τους οποίους οι δομές Lewis και τα πραγματικά μόρια μπορούν να διαφέρουν είναι ότι τα άτομα μπορούν να δημιουργήσουν μόρια που δεν είναι σταθερά, παρόλο που στις δομές Lewis θεωρείται ότι τα άτομα θα επιδιώξουν να γεμίσουν ή θα πρέπει να γεμίσουν το κέλυφος σθένους τους. Ο αριθμός των ηλεκτρονίων σθένους μπορεί περιστασιακά να υπερβαίνει τα οκτώ, αυτό είναι πιθανό να συμβεί όταν ο ατομικός αριθμός ενός στοιχείου είναι ιδιαίτερα υψηλός. Επειδή τα στοιχεία υψηλότερων ατομικών αριθμών έχουν περιστασιακά ηλεκτρόνια σθένους που υπερβαίνουν το οκτώ, οι δομές Lewis δεν είναι τόσο χρήσιμες για τη δημιουργία μοντέλων μετάλλων μετάπτωσης όσο δημιουργούν μοντέλα των ελαφρών στοιχείων. Τα μέταλλα μετάπτωσης όπως οι ακτινίδες και οι λανθανίδες είναι παραδείγματα μετάλλων μετάπτωσης που μπορεί να έχουν περισσότερα από οκτώ ηλεκτρόνια σθένους. Για αυτούς τους λόγους, είναι σημαντικό να γνωρίζετε ότι ενώ οι δομές Lewis μπορούν να σας βοηθήσουν να κατανοήσετε πώς συμπεριφέρονται τα άτομα στα μόρια, δεν θα πρέπει να θεωρηθεί ότι η δομή Lewis είναι μια τέλεια αναπαράσταση των μορίων.’
Ανάγνωση του περιοδικού πίνακα για τον προσδιορισμό του αριθμού των ηλεκτρονίων σθένους
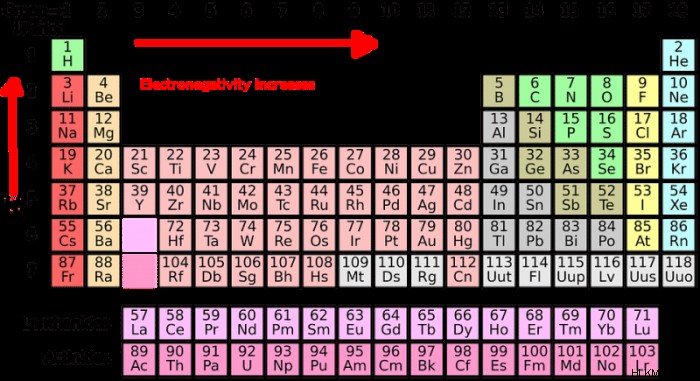
Μπορείτε να εξετάσετε τον περιοδικό πίνακα των στοιχείων για να προσδιορίσετε τον αριθμό των ηλεκτρονίων σθένους για ένα συγκεκριμένο στοιχείο. Τα στοιχεία στον περιοδικό πίνακα είναι διατεταγμένα σε ορισμένα μοτίβα και η παρατήρηση της διάταξης του πίνακα μπορεί να σας βοηθήσει να καταλάβετε ποια στοιχεία έχουν πόσα ηλεκτρόνια σθένους. Ο περιοδικός πίνακας ταξινομεί τα στοιχεία κατά χημική αντιδραστικότητα ή με αριθμό ηλεκτρονίων σθένους, καθώς τα ηλεκτρόνια σθένους καθορίζουν τη χημική δραστηριότητα του στοιχείου.
Οι στήλες ή οι ομάδες στον περιοδικό πίνακα περιέχουν όλες στοιχεία που έχουν ισοδύναμο αριθμό ηλεκτρονίων σθένους. Για παράδειγμα, ρίξτε μια ματιά στην πρώτη ομάδα ή στήλη στον περιοδικό πίνακα. Αυτή η ομάδα περιέχει υδρογόνο, καίσιο, νάτριο και κάλιο μεταξύ άλλων στοιχείων. Κάθε στοιχείο σε αυτή την πρώτη ομάδα έχει ένα ηλεκτρόνιο σθένους. Προχωρώντας σε μια στήλη, τα στοιχεία που βρίσκονται στην ομάδα 2 του περιοδικού πίνακα, όπως το μαγνήσιο, το βηρύλλιο και το ασβέστιο, διαθέτουν όλα δύο ηλεκτρόνια σθένους.
Σημειώστε ότι τα μέταλλα μετάπτωσης στο μεσαίο τμήμα του περιοδικού πίνακα παραλείπονται στην ομαδοποίηση των στοιχείων κατά ηλεκτρόνια σθένους, λόγω του τρόπου με τον οποίο λειτουργεί η διαμόρφωση ηλεκτρονίων σε αυτά τα στοιχεία. Με εξαίρεση τα μέταλλα μετάπτωσης, η τάση στον περιοδικό πίνακα ισχύει μέχρι να φτάσει η όγδοη και τελευταία στήλη του πίνακα. Τα πιο σταθερά στοιχεία παρατίθενται σε αυτήν την ομάδα ή στήλη, το καθένα από τα οποία έχει ήδη οκτώ ηλεκτρόνια στο περίβλημα σθένους. Αυτά τα στοιχεία αναφέρονται ως ευγενή αέρια και περιλαμβάνουν στοιχεία όπως αργό, νέον και κρυπτό.