Πώς ζυγίζετε ένα άτομο;
Τα άτομα είναι πολύ μικρά για να ζυγίζονται σε κανονικές κλίμακες, έτσι οι φυσικοί χρησιμοποιούν ένα φασματόμετρο μάζας. Αυτή η συσκευή χρησιμοποιεί ηλεκτρικά και μαγνητικά πεδία για να προσδιορίσει τη μάζα ενός ατόμου.
Λοιπόν, θα πρέπει να είναι αρκετά εύκολο, σωστά; Απλώς ρίξτε ένα άτομο στη ζυγαριά σας, σίγουρα αυτό με τη μέγιστη ευαισθησία και voila— έχετε τις μετρήσεις σας!
Τι γίνεται όμως με όλα τα νεκρά κύτταρα του δέρματος; Έχουν πάχος τρισεκατομμυρίων ατόμων, ξεφλουδίζουν από το χέρι σας και φτερουγίζουν κάτω στην ζυγαριά, θάβοντας το άτομό σας σε ένα σωρό από ατομικά σκουπίδια. Εν τω μεταξύ, άλλα ατμοσφαιρικά σωματίδια εκτοξεύονται, αναπηδούν πάνω και έξω από το μηχάνημά σας, στέλνοντας την ευαίσθητη στο άτομο βελόνα του να χτυπά μπρος-πίσω σαν υαλοκαθαριστήρας. Όλα αυτά θα εμποδίσουν τις μετρήσεις μας, σωστά;

Οι παραδοσιακές ζυγαριές δεν μπορούν να μετρήσουν τόσο μικρές μάζες (Φωτογραφία (Προσφορά:PxHere)
Αληθής. Ωστόσο, επιτρέψτε μου να σας ρωτήσω αυτό… πώς απομονώσατε ένα μεμονωμένο άτομο στην αρχή;
Πόσο μικρό είναι ένα άτομο;
Πιθανότατα γνωρίζετε ότι τα πάντα αποτελούνται από μικροσκοπικά μικρά πράγματα που ονομάζονται άτομα. ένα άτομο αποτελείται από ακόμη μικρότερα σωματίδια, δηλαδή πρωτόνια, νετρόνια και ηλεκτρόνια. Έχετε επίσης ακούσει πιθανώς ότι τα άτομα είναι μικρά, αλλά έχετε σκεφτεί ποτέ πόσο μικρά είναι στην πραγματικότητα;
Για να κατανοήσουμε τη μικροσκοπική τους κλίμακα λίγο καλύτερα, ας εξετάσουμε ένα γκρέιπφρουτ. Ας υποθέσουμε ότι το γκρέιπφρουτ αποτελείται μόνο από άτομα αζώτου (κάτι που δεν είναι αλήθεια, αλλά για να μειώσουμε την πολυπλοκότητα του προβλήματος, θα το υποθέσουμε). Αφήστε κάθε ένα από αυτά τα άτομα αζώτου να έχει το μέγεθος ενός μύρτιλου. Πόσο μεγάλο θα πρέπει να είναι το γκρέιπφρουτ;

Θα είχε το ίδιο μέγεθος με τον πλανήτη Γη. Είναι απλά τρελό, έτσι δεν είναι; Γίνεται ακόμα πιο τρελό αν προσπαθήσετε να κλιμακώσετε το μέγεθος των υποατομικών σωματιδίων!
Στο κέντρο ενός ατόμου βρίσκεται μια φανταστική σφαίρα που ονομάζεται πυρήνας, η οποία περιέχει νετρόνια και πρωτόνια και στο εξωτερικό βρίσκονται τα ηλεκτρόνια. Εάν ένα άτομο διευρυνόταν στο μέγεθος ενός μεγάλου γηπέδου ποδοσφαίρου, ο πυρήνας δεν θα ήταν μεγαλύτερος από έναν κόκκο άμμου που κάθεται στο κέντρο του σταδίου. Στις άκρες του σταδίου βρίσκονται τα ηλεκτρόνια και το υπόλοιπο είναι απλώς κενός χώρος.
Τώρα που είστε ανανεωμένοι στον μικροσκοπικό κόσμο ενός ατόμου, πώς θα μπορούσατε να παρατηρήσετε ένα τόσο μικροσκοπικό πράγμα με γυμνό μάτι, πόσο μάλλον να το χειριστείτε και να το ζυγίσετε ακόμα και στην πιο ευαίσθητη ζυγαριά σας;
Λοιπόν πώς το κάνουν;
Ο Νεύτωνας μας βοήθησε και σε αυτό. Ο δεύτερος νόμος της κίνησής του, F=ma, όπου «a» είναι η επιτάχυνση ενός σώματος που έχει μάζα «m» όταν επενεργεί πάνω του μια δύναμη «F», είναι η βασική ιδέα πίσω από τη μέτρηση ενός ατόμου.
Ένα όργανο γνωστό ως φασματόμετρο μάζας χρησιμοποιείται για τη διεξαγωγή του πειράματος.
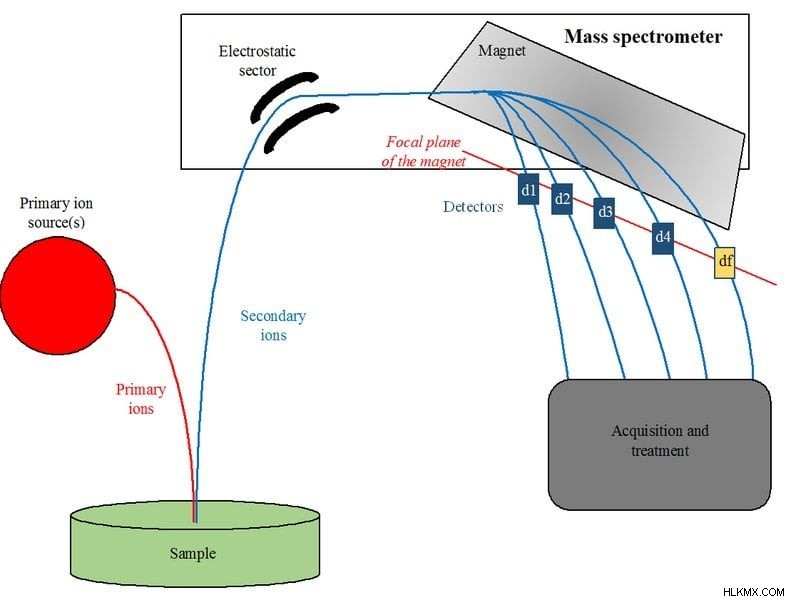
Λειτουργία φασματόμετρου μάζας (Φωτογραφία:Eden Camp/Wikimedia Commons)
Λειτουργία φασματόμετρου μάζας
Το πρώτο βήμα είναι να ιονιστεί ένα αέριο που αποτελείται από άτομα πυροδοτώντας μια δέσμη σωματιδίων στο αέριο, το οποίο είτε προσθέτει ηλεκτρόνια στα άτομα είτε αφαιρεί μερικά από τα ηλεκτρόνια τους, ανάλογα με τον τύπο της δέσμης σωματιδίων που χρησιμοποιείται. Αυτό δίνει στα άτομα ένα καθαρό αρνητικό ή θετικό ηλεκτρικό φορτίο και σχηματίζουν ιόντα.

Στη συνέχεια, αυτά τα ιόντα διέρχονται μέσω ενός σωλήνα στον οποίο υπόκεινται σε ηλεκτρικά και μαγνητικά πεδία . Και τα δύο αυτά πεδία ασκούν δύναμη στα ιόντα. Η ηλεκτρική δύναμη αλλάζει την ταχύτητα των ιόντων, ενώ η μαγνητική δύναμη κάμπτει την πορεία τους.
Στη συνέχεια, τα ιόντα συλλέγονται από κύπελλα Faraday (ένα μεταλλικό κύπελλο σχεδιασμένο για να πιάνει φορτισμένα σωματίδια στο κενό) στο άκρο του σωλήνα, δημιουργώντας ένα ρεύμα στα καλώδια που συνδέονται με τα κύπελλα. Μετρώντας πότε και πού το ρεύμα των ιόντων χτύπησε τα κύπελλα Faraday, οι φυσικοί μπορούν να προσδιορίσουν την επιτάχυνση και την κατεύθυνση των ιόντων, υπό την επίδραση ηλεκτρικών και μαγνητικών πεδίων.
Τέλος, μέσω του δεύτερου νόμου κίνησης του Νεύτωνα, F=ma που αναδιατάσσεται ως m=F/a, διαιρείτε τη συνολική δύναμη που ασκεί στα ιόντα με την προκύπτουσα επιτάχυνσή τους για να προσδιορίσετε τη μάζα των ιόντων. Ομοίως, προσδιορίζουμε τη μάζα ενός ηλεκτρονίου χρησιμοποιώντας ένα φασματόμετρο μάζας.

Τώρα που έχουμε τη μέτρηση για τις μάζες τόσο των ιόντων όσο και των ηλεκτρονίων, μπορούμε να προσθέσουμε και να αφαιρέσουμε τις μάζες αναλόγως για να βρούμε τη μάζα του αρχικού ατόμου, το οποίο ήταν ελεύθερο ή με περίσσεια ηλεκτρονίων.
Χρησιμοποιώντας ένα φασματόμετρο μάζας, οι φυσικοί προσδιόρισαν τη μάζα ενός ατόμου υδρογόνου να είναι 1,6737236 × 10^-27 kg kg. Αυτό είναι αρκετά ακριβές για τους περισσότερους σκοπούς.
Η παλιά μέθοδος
Πριν από την απλότητα ενός «φασματόμετρου μάζας», η έρευνα γινόταν ακόμα στη σωματιδιακή φυσική, αλλά η ιδέα ενός ατόμου ήταν πολύ ασαφής. Εκείνες τις μέρες, το βάρος των ατόμων που αποτελούσαν ένα στοιχείο μετρούνταν ως προς τις σχετικές μάζες και όχι με την πραγματική μάζα.
Ένας Ιταλός επιστήμονας, ο Amedeo Avogadro, συνειδητοποίησε ότι ο όγκος οποιουδήποτε αερίου (σε δεδομένη πίεση και θερμοκρασία) είναι ανάλογος με τον αριθμό των ατόμων ή των μορίων που το συνθέτουν. αυτό ήταν μια σημαντική ανακάλυψη. Επέτρεψε στους φυσικούς να συγκρίνουν τα σχετικά βάρη ίσων όγκων διαφορετικών αερίων για να προσδιορίσουν τις σχετικές μάζες των ατόμων που τα συνθέτουν.

Τα ατομικά βάρη μετρήθηκαν ως μονάδες ατομικής μάζας (amu), όπου 1 amu ήταν ίσο με το ένα δωδέκατο της μάζας ενός ατόμου άνθρακα-12. Αμέσως μετά, εμφανίστηκε η περίφημη σταθερά, γνωστή ως αριθμός του Avogadro (6.023 × 1023). Αυτός ο αριθμός παρέχει τον αριθμό των ατόμων ή των μορίων που υπάρχουν σε ένα mole (ποσότητα ουσίας ενός συστήματος που περιέχει τόσες στοιχειώδεις οντότητες όσα άτομα υπάρχουν σε 0,012 κιλά άνθρακα-12.) ενός αερίου. Αυτό τους βοήθησε να παράγουν χονδρικές εκτιμήσεις για τη μάζα ενός ατόμου ζυγίζοντας τον όγκο ολόκληρου του αερίου και διαιρώντας με τον αριθμό του Avogadro.




