Γιατί οι τιμές pH είναι μόνο σε εύρος 0-14;
Ένα pH εκτός του συμβατικού εύρους 0-14 είναι δυνατό, αλλά διάφοροι περιορισμοί που προκαλούνται από τα όργανα και το ίδιο το διάλυμα μας περιορίζουν από τη μέτρηση μιας τέτοιας ουσίας.
Συχνά επισημαίνουμε το νερό ως ουδέτερο διάλυμα με pH 7. Επίσης, κάθε διάλυμα που φαίνεται όξινο λέγεται ότι έχει pH μικρότερο από 7, ενώ ένα που είναι βασικό λέγεται ότι έχει pH μεγαλύτερο από 7. Ωστόσο, τι είναι αυτοί οι αριθμοί και τι μας λένε για τη λύση; Είναι αλήθεια ότι ένα διάλυμα μπορεί να έχει τιμές pH μόνο στην περιοχή 0f 0-14;
Τι είναι η κλίμακα pH;
Η κλίμακα pH χρησιμοποιείται για να προσδιοριστεί εάν μια ουσία είναι όξινη ή βασική και για να υπολογιστεί πόσο ισχυρή είναι μια χημική ουσία. Μια τιμή pH είναι ένας αριθμός που κυμαίνεται από 1 έως 14 για τις περισσότερες κοινές χημικές ουσίες, με επτά να είναι το μεσαίο ή ουδέτερο σημείο. Οι τιμές κάτω από το 7 είναι δείκτες οξύτητας, η οποία αυξάνεται όσο μειώνεται ο αριθμός, ενώ τιμές πάνω από 7 υποδηλώνουν αλκαλικότητα, η οποία αυξάνεται καθώς αυξάνεται η τιμή. Ένα ενδιαφέρον πράγμα που πρέπει να σημειωθεί εδώ είναι ότι η κλίμακα pH δεν είναι γραμμική κλίμακα. Με άλλα λόγια, ένα οξύ με ph 3 δεν είναι δύο φορές πιο ισχυρό από ένα οξύ με pH 6. Μια σημαντική διάκριση που πρέπει να κατανοήσουμε είναι ότι η κλίμακα pH είναι μια λογαριθμική κλίμακα.
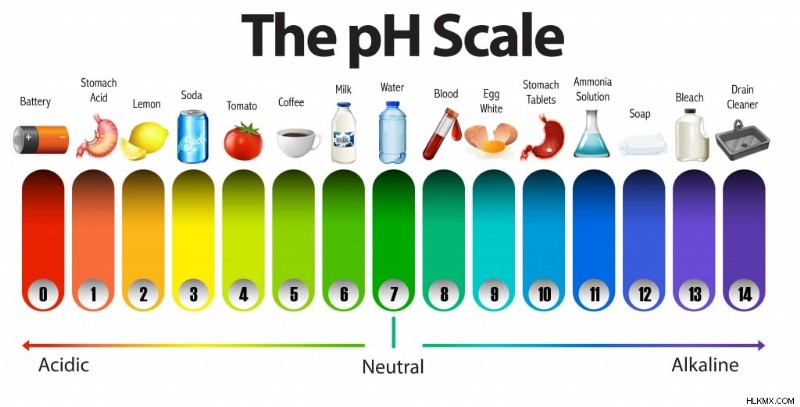
Μια κλίμακα pH (Photo Credit :BlueRingMedia/ Shutterstock)
Ο επίσημος ορισμός του pH αποκαλύπτει ότι είναι απλώς ένα μέτρο της δραστηριότητας των ιόντων υδρογόνου σε έναν δεδομένο διαλύτη. Η δραστηριότητα εδώ σημαίνει ότι η κίνησή τους είναι ελεύθερη, κάτι που είναι δυνατό μόνο εάν η χημική ουσία έχει ιονιστεί, απελευθερώνοντας έτσι ιόντα στο διάλυμα.
τύπος pH
Ο τύπος για τον υπολογισμό του pH μοιάζει κάπως έτσι:pH=−log10[Hsolvated].
Αυτή είναι μια λογαριθμική εξίσωση με βάση το 10. Σε αυτήν την κλίμακα, μια ουσία με ph 3 είναι δέκα φορές πιο όξινη από μια ουσία με pH 4 και 100 φορές πιο όξινη από μια ουσία με pH 5. Ομοίως , μια ουσία με pH 9 είναι δέκα φορές πιο αλκαλική από μια ουσία με pH 8 και 1000 φορές πιο αλκαλική από μια ουσία με pH 6.
Τι σημαίνει το p στο pH;
Η ιστορία πίσω από την ανακάλυψη της κλίμακας pH είναι αρκετά ενδιαφέρουσα. Η έννοια του pH εισήχθη για πρώτη φορά από έναν χημικό ονόματι Soren Peder Lauritz, ο οποίος εργάστηκε στο εργαστήριο Carlsberg στην Κοπεγχάγη της Δανίας. Η πρώτη αναφορά αυτού του όρου έμοιαζε κάπως έτσι— pH—ένα μικρό p με ένα H στον δείκτη.

Δανός χημικός Soren Peter Lauritz (Φωτογραφία :Public Domain/Wikimedia Commons)
Ενώ το Η αντιπροσωπεύει τη συγκέντρωση ιόντων υδρογόνου πάνω στην οποία περιστρέφεται ολόκληρη η έννοια, η ακριβής σημασία του p αμφισβητείται ιδιαίτερα. Η κλίμακα μετρά βασικά ένα δυναμικό διαφορά μεταξύ διαφορετικών λύσεων μετρώντας την αρνητική ισχύ των δέκα. Και οι δύο αυτές λέξεις—«δύναμη» και «δυναμικό»—αρχίζουν με p και στις τρεις γλώσσες (γαλλικά, γερμανικά και δανικά) που μίλησε ο Sorensen και δημοσίευσε την έρευνά του. Δεδομένης αυτής της ασάφειας, η έννοια του p παραμένει ένα από τα μεγάλα μυστήρια στον τομέα της χημείας, αν και δεν είναι κάτι υπερβολικά κρίσιμο για την ίδια την έννοια.
Μπορούμε να έχουμε τιμές pH εκτός του εύρους 0-14;
Θεωρητικά μιλώντας, η κλίμακα του pH θα πρέπει στην πραγματικότητα να κυμαίνεται από αρνητικό άπειρο έως θετικό άπειρο. Αυτός ο ισχυρισμός είναι σύμφωνα με τον ορισμό του, ο οποίος δηλώνει ότι το pH μιας ουσίας είναι η τιμή που ορίζεται από τον αρνητικό λογάριθμο της συγκέντρωσης ιόντων υδρογόνου. Ωστόσο, στην πραγματικότητα, οι περισσότερες λύσεις που θα βρείτε σε ένα τυπικό εργαστήριο έχουν τιμή pH μεταξύ 0-14. Αυτό συμβαίνει επειδή, για να φτάσει κανείς σε επίπεδα pH κάτω από 0 ή πάνω από 14, θα χρειαζόταν εξαιρετικά όξινα ή βασικά διαλύματα, αντίστοιχα.
Ένα κορεσμένο διάλυμα υδροξειδίου του νατρίου (NaOH) υποτίθεται ότι έχει pH 15 με βάση τη μοριακότητά του. Ωστόσο, η χημική ουσία δεν θα είναι σε θέση να επιδιαλυτωθεί εξ ολοκλήρου λόγω της παρουσίας νερού, το οποίο λειτουργεί ως εμπόδιο για τη διάλυση (διάσπαση) μεγαλύτερων μορίων. Αυτό, με τη σειρά του, θα οδηγήσει σε μείωση της απελευθέρωσης ιόντων υδροξειδίου (OH–), τα οποία είναι ιόντα που απορροφούν τα ιόντα υδρογόνου, αυξάνοντας το pH του διαλύματος.
Είναι δυνατό ένα αρνητικό pH;
Η επίτευξη αρνητικού βαθμού pH είναι σίγουρα δυνατή. Στην πράξη, κάθε οξύ που αποδίδει συγκέντρωση ιόντων υδρογόνου με μοριακότητα μεγαλύτερη από μία θα εμφανίζει αρνητικό pH όταν υπολογίζεται. Ωστόσο, αν ένα οξύ στην πραγματικότητα έχει μια αρνητική τιμή pH δεν είναι κάτι που μπορεί να επαληθευτεί αποτελεσματικά σε ένα εργαστήριο.

pH μετρητής ηλεκτροδίου γυαλιού (Πιστωτική φωτογραφία :Sakan.p/ Shutterstock)
Για να το θέσουμε σε προοπτική, σκεφτείτε ένα διάλυμα υδροχλωρικού οξέος 12 Μ (HCL). Αυτή η χημική ουσία θα πρέπει να έχει pH -1,08, που είναι μία μονάδα πάνω από την τυπική κλίμακα pH, αλλά δεν μπορούμε να το μετρήσουμε με κανένα γνωστό όργανο. Το χαρτί λακκούβας (το πιο κοινό μέσο μέτρησης του pH) υποδεικνύει μόνο εάν η τιμή του pH είναι πάνω ή κάτω από το επτά. Ως εκ τούτου, οι μετρητές pH είναι απαραίτητοι για τον καθορισμό της πραγματικής τιμής. Ωστόσο, ακόμη και τα pH μετρητές ηλεκτροδίων από γυαλί αποτυγχάνουν σε τέτοιες ακραίες εργασίες λόγω κάτι που ονομάζεται όξινο σφάλμα, το οποίο αναγκάζει ακόμη και αυτές τις εξαιρετικά προηγμένες συσκευές να μετρούν ένα pH υψηλότερο από την πραγματική τιμή. Ακόμα κι αν βελτιώσουμε την αποτελεσματικότητα αυτών των οργάνων και επιτύχουμε την «τελειότητα» (που φαίνεται σχεδόν αδύνατο), εξακολουθεί να υπάρχει ένα τελικό πρόβλημα:η αποτελεσματική συγκέντρωση.
Τι είναι η αποτελεσματική συγκέντρωση;
Τα ισχυρά οξέα δεν διασπώνται ποτέ πλήρως στο νερό για να απελευθερώσουν τον αριθμό των ιόντων υδρογόνου που απαιτούνται για να φέρει το μετρητή της συσκευής σε αρνητική τιμή. Αυτό που τονίζει αυτό το πρόβλημα είναι η αποτελεσματική συγκέντρωση ιόντων υδρογόνου, η οποία είναι πάντα μικρότερη από την πραγματική συγκέντρωση, καθώς υπάρχει πολύ λίγο νερό ανά μονάδα οξέος σε ισχυρά και πυκνά διαλύματα οξέος. Το νερό βοηθά στη διάσπαση των οξέων, απελευθερώνοντας ιόντα υδρογόνου στη διαδικασία. Αυτό οφείλεται στο γεγονός ότι το νερό είναι ένα μόριο διπόλου και δημιουργεί καθαρή αποτελεσματική κίνηση του διπόλου. Ωστόσο, ελλείψει νερού, τα μόρια του οξέος δεν διασπώνται όσο θα έπρεπε, γεγονός που καθιστά το pH πολύ υψηλότερο από αυτό που θα περίμενε κανείς με βάση τη μοριακότητά τους.
Μια τελευταία λέξη
Συμπερασματικά, είναι όντως δυνατό να έχουμε pH εκτός του συμβατικού εύρους 0-14. Ωστόσο, σε τέτοιες περιπτώσεις, το pH αποτυγχάνει να είναι ένα χρήσιμο ή και σημαντικό μέτρο λόγω των διαφόρων περιορισμών που προκαλούνται από τα όργανα και το ίδιο το διάλυμα. Για την επισήμανση διαλυμάτων υψηλής συγκέντρωσης, πρέπει να χρησιμοποιείται απευθείας συγκέντρωση, όπως η μοριακότητα.
Από μια απλή προοπτική, αυτό που κάνει το pH είναι να βοηθάει να φέρουμε εξαιρετικά μικρές συγκεντρώσεις Η+ σε ένα πιο οικείο εύρος αριθμών, αλλά καθώς οι συγκεντρώσεις γίνονται μεγαλύτερες, αυτή η πρακτική χάνει την αξία της και αντ' αυτού γίνεται αντιπαραγωγική. Ας ελπίσουμε ότι, με την πάροδο του χρόνου, θα υπάρξουν ορισμένες τροποποιήσεις που θα βελτιώσουν την αποτελεσματικότητα και την ακρίβεια των ακραίων μετρήσεών μας. Άλλωστε, το pH είναι μια από τις πιο διάσημες και χρήσιμες έννοιες στον κόσμο της χημείας, και στον τομέα της επιστήμης, η ακρίβεια είναι απαραίτητη!









