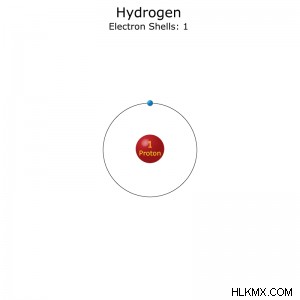
Στοιχεία για το υδρογόνο 1
Το υδρογόνο (Η) είναι το πρώτο στοιχείο του περιοδικού πίνακα και το πιο άφθονο στοιχείο στο σύμπαν. Ακολουθεί μια συλλογή στοιχείων για το υδρογόνο, συμπεριλαμβανομένων των ιδιοτήτων, των χρήσεων και των πηγών του.

Βασικά στοιχεία για το υδρογόνο
Όνομα: Υδρογόνο
Ατομικός αριθμός: 1
Σύμβολο στοιχείου: H
Ομάδα: 1
Περίοδος: 1
Αποκλεισμός: s
Οικογένεια στοιχείων: Μη μέταλλο
Ατομική μάζα: [1,00784; 1.00811] Κατευθυντήριες γραμμές IUPAC
Το 1,008 χρησιμοποιείται συνήθως για μια μεμονωμένη τιμή
Διαμόρφωση ηλεκτρονίου: 1s
Ανακάλυψη: Ο Henry Cavendish το 1766.
Ο Κάβεντις ήταν ο πρώτος που αναγνώρισε το υδρογόνο ως στοιχείο. Άλλοι είχαν ετοιμάσει δείγματα αερίου υδρογόνου χωρίς να το προσδιορίσουν ως στοιχείο. Ο Κάβεντις αποκάλεσε την ανακάλυψή του «εύφλεκτο αέρα». Ο Antoine Lavoisier πρότεινε το όνομα «υδρογόνο» το 1783 και το υδρογόνο υιοθετήθηκε αμέσως μετά.
Προέλευση ονόματος: Hydro (ελληνικά σημαίνει «νερό») Γονίδιο (ελληνικά «σχηματισμός»). Ο Lavoisier έδειξε ότι αν καίγετε υδρογόνο με οξυγόνο, σχηματιζόταν νερό.
Κοινά ισότοπα:
H
Το Protium είναι το πιο κοινό ισότοπο. Έχει 1 πρωτόνιο και 1 ηλεκτρόνιο. Το 99,98% όλου του φυσικού υδρογόνου είναι πρωτίου.
H
Το δευτέριο είναι 1 πρωτόνιο, 1 νετρόνιο και 1 ηλεκτρόνιο. Αυτό το ισότοπο συνήθως υποδηλώνεται με το γράμμα D. Το όνομα προέρχεται από την ελληνική λέξη «deuteros " που σημαίνει "δεύτερος". Περίπου το 0,02% του φυσικού υδρογόνου είναι δευτέριο.
H
Το τρίτιο περιέχει 1 πρωτόνιο, 2 νετρόνια και 1 ηλεκτρόνιο. Αυτό το ισότοπο si συνήθως υποδηλώνεται με το γράμμα Τ. Το όνομα προέρχεται από την ελληνική λέξη «τρίτος " που σημαίνει "τρίτος". Το Trition είναι ραδιενεργό και διασπάται με β διάσπαση σε He-3 με χρόνο ημιζωής 12,32 ± 0,02 χρόνια. Το 10% του φυσικού υδρογόνου είναι τρίτιο.

Φυσικά δεδομένα
Πυκνότητα: 0,000082 g/cm
Σημείο τήξης: 13,99 K (-259,16 ºC ή -434,182 ºF)
Σημείο βρασμού: 20,271 K (-252,879 ºC ή -423,182 ºF)
Τριπλό σημείο: 13,8033 K στα 7,041 kPa
Κρίσιμο σημείο: 32,938 K στα 1,2858 MPa
Κατάσταση στους 20ºC: Αέριο
Heat of Fusion: 0,117 kJ/mol για H2 .
Θερμότητα εξάτμισης: 0,904 kJ/mol για H2 .
Μοριακή θερμική χωρητικότητα: 28.836 J/mol·K για H2 .
Ατομικά δεδομένα
Ατομική ακτίνα: 1,10 Å
Ομοιοπολική ακτίνα: 0,32 Å
Ακτίνα Van der Waals: 1.2 Å
Συγγένεια ηλεκτρονίων: 72,769 kJ/mol
Ηλεκτραρνητικότητα: (Κλίμακα Pauling):2,20
1 Ενέργεια Ιονισμού: 1312,05 kJ/mol
Συνήθεις καταστάσεις οξείδωσης: 1, -1

Διασκεδαστικά γεγονότα
- Το υδρογόνο είναι το ελαφρύτερο από τα στοιχεία.
- Το υδρογόνο είναι το πιο άφθονο από τα στοιχεία που αντιπροσωπεύει περίπου το 75% της μάζας των στοιχείων του σύμπαντος.
- Το αέριο υδρογόνο σε θερμοκρασία και πίεση δωματίου είναι άχρωμο και άοσμο.
- Το αέριο υδρογόνο σε θερμοκρασία και πίεση δωματίου είναι 14 φορές ελαφρύτερο από τον αέρα. Είναι τόσο ελαφρύ, που μπορεί να ξεφύγει από τη βαρύτητα της Γης και να εισέλθει στο διάστημα.
- Το αέριο υδρογόνο είναι εξαιρετικά εύφλεκτο όταν αναμιγνύεται με οξυγόνο. Η καύση αερίου υδρογόνου ήταν υπεύθυνη για τη διάσημη καταστροφή του αερόπλοιου Hindenburg.
- Η καύση αερίου υδρογόνου παράγει νερό.
- Μπορεί να παραχθεί αέριο υδρογόνο με αντίδραση μετάλλου με οξύ.
- Τα θετικά ιόντα υδρογόνου ονομάζονται υδρόνια. Τα αρνητικά ιόντα υδρογόνου είναι υδρίδια.
- Το υδρογόνο χρησιμοποιείται σε μεγάλο βαθμό στη βιομηχανία για την παραγωγή αμμωνίας και την επεξεργασία ορυκτών καυσίμων.
- Το υδρογόνο συχνά παρασκευάζεται με ηλεκτρόλυση νερού. Παρασκευάζεται επίσης με ροή ατμού σε θερμαινόμενο άνθρακα ή με αντίδραση οξέων σε μέταλλα.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.