Η εξίσωση Van der Waals έγινε εύκολη
Βασικές έννοιες της εξίσωσης Van der Waals
Σε αυτό το άρθρο, θα μάθετε για μια από τις εξισώσεις κατάστασης που μπορεί να χρησιμοποιηθεί για να περιγράψει την κατάσταση ενός μη ιδανικού αερίου - την Εξίσωση Van Der Waals .
Θέματα που καλύπτονται σε άλλα άρθρα
- Νόμος του Καρόλου
- Νόμος του Avogadro
- Νόμος του Μπόιλ
- Ο νόμος του ιδανικού αερίου
- Κινητική Μοριακή Θεωρία
Εισαγωγή της εξίσωσης Van der Waals
Οι περισσότεροι από τους νόμους για τα αέρια που πιθανώς έχετε μάθει ισχύουν μόνο για τα ιδανικά αέρια. Τα ιδανικά αέρια περιλαμβάνουν μια σειρά από υποθέσεις για τις οποίες μπορείτε να μάθετε στο άρθρο μας σχετικά με τον νόμο των ιδανικών αερίων, Ο νόμος του ιδανικού αερίου . Ωστόσο, αυτές οι υποθέσεις δεν ισχύουν πραγματικά για ορισμένα αέρια που μπορεί να αντιμετωπίσετε. Ας μάθουμε λοιπόν για την εξίσωση Van der Waals.
Για να είναι ένα αέριο ιδανικό, η πίεση πρέπει να είναι χαμηλή, ιδανικά κοντά στην ατμοσφαιρική πίεση, έτσι ώστε ο όγκος των σωματιδίων του αερίου να είναι αμελητέος σε σύγκριση με τον όγκο του συστήματος.
Επιπλέον, η θερμοκρασία πρέπει να είναι υψηλή, ώστε η κινητική ενέργεια των σωματιδίων του αερίου να μην επηρεάζεται πολύ από τις διαμοριακές δυνάμεις. Σε χαμηλές θερμοκρασίες, οι διαμοριακές δυνάμεις έχουν μεγαλύτερη επίδραση στην κίνηση των σωματιδίων, αλλά καθώς αυξάνεται η κινητική ενέργεια, η κρούση μειώνεται.
Διορθωτικοί παράγοντες
Σε περιοχές πίεσης και θερμοκρασίας εκτός του ιδανικού εύρους αερίου, πρέπει να προσθέσουμε συντελεστές διόρθωσης στην εξίσωση ιδανικού αερίου για να τους λάβουμε υπόψη.
Ο πρώτος συντελεστής διόρθωσης είναι να ληφθεί υπόψη ο όγκος που καταλαμβάνει ένα πραγματικό αέριο. Αν λάβουμε υπόψη ολόκληρο τον όγκο του δοχείου, ο όγκος του αερίου θα αφαιρεθεί από αυτό. Επομένως, μπορούμε να προσθέσουμε έναν συντελεστή διόρθωσης στην εξίσωση:
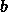
Οπου 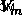 είναι ο μοριακός όγκος του αερίου και
είναι ο μοριακός όγκος του αερίου και 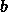 είναι ο όγκος που καταλαμβάνει ένα mole του αερίου.
είναι ο όγκος που καταλαμβάνει ένα mole του αερίου.
Ο δεύτερος διορθωτικός όρος που πρέπει να προστεθεί είναι οι διαμοριακές αλληλεπιδράσεις προσθέτοντας στην πίεση. Μπορούμε τώρα να ξαναγράψουμε την εξίσωση ως:
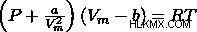
Αυτή είναι η εξίσωση κατάστασης Van der Waals και μπορεί να χρησιμοποιηθεί για μη ιδανικά αέρια, όπως σε αυτό το παράδειγμα. Υπάρχουν και άλλες εξισώσεις κατάστασης, και η εξίσωση κατάστασης που πρέπει να χρησιμοποιήσετε εξαρτάται από την κατάσταση.




