Αντίδραση Diels-Alder
Βασικές έννοιες
Σε αυτό το σεμινάριο οργανικής χημείας, θα μάθετε τα βασικά της αντίδρασης Diels-Alder, συμπεριλαμβανομένης της χημείας των προϊόντων και των αντιδρώντων της, του μηχανισμού της, της τοποεπιλεκτικότητάς της και ορισμένων σημαντικών παραλλαγών αντίδρασης.
Αντιδρώντα και προϊόν Diels-Alder
Η αντίδραση Diels-Alder σχηματίζει ένα κυκλοαλκένιο έξι άνθρακα από δύο μικρότερες δομές άνθρακα. Συγκεκριμένα, τα δύο αντιδρώντα ονομάζονται διένιο και διενόφιλο. Η απλούστερη αντίδραση Diels-Alder χρησιμοποιεί 1,3-βουταδιένιο και αιθένιο.
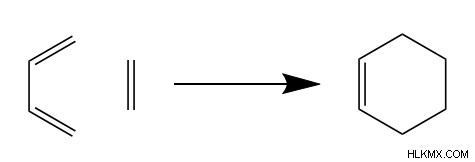
Το διένιο, το αποκαλούμενο από τους χημικούς λόγω των δύο διπλών δεσμών του, παρέχει τέσσερις από τους έξι άνθρακες στο κυκλικό προϊόν. Είναι ενδιαφέρον ότι οι δύο διπλοί δεσμοί του διενίου πρέπει να είναι cis μεταξύ τους για να αντιδράσουν με το διενόφιλο και να είναι συζευγμένοι, πράγμα που σημαίνει ότι τα ηλεκτρόνια pi στους διπλούς δεσμούς πρέπει να κινούνται σε συντονισμό. Αυτή η συντονισμένη κίνηση παίζει καθοριστικό ρόλο στον μηχανισμό του Diels-Alder, όπως θα δούμε σύντομα. Το διενόφιλο, αποκαλούμενο λόγω της αντιδραστικότητάς του με το διένιο, παρέχει δύο από τους άνθρακες στο προϊόν και έχει διπλό δεσμό μεταξύ αυτών των ανθράκων.
Εκτός από τους έξι άνθρακες που συνθέτουν τη δομή του κυκλικού προϊόντος, το διένιο και το διενόφιλο μπορεί να έχουν πολλές διαφορετικές δομές και να υποβάλλονται ακόμη σε μια αντίδραση Diels-Alder. Στην πραγματικότητα, ένα μόριο μπορεί να λειτουργήσει και ως διένιο και ως διενόφιλο, όπως φαίνεται παρακάτω με το κυκλοπενταδιένιο.

Μηχανισμός αντίδρασης Diels-Alder
Πρώτον, το διένιο και το διενόφιλο πρέπει να αλληλεπιδράσουν με έναν συγκεκριμένο προσανατολισμό που ευθυγραμμίζει καθέναν από τους άνθρακες του διενόφιλου με τους άνθρακες 1 και 4 του διενίου. Στη συνέχεια, σχηματίζεται μια μεταβατική κατάσταση παρόμοια με το βενζόλιο, που περιλαμβάνει την κυκλική κίνηση των ηλεκτρονίων για να σχηματίσουν δύο δεσμούς σίγμα μεταξύ των αντιδρώντων. Επίσης, ένας δεσμός pi σχηματίζεται μεταξύ των ανθράκων 2 και 3 του διενίου. Αυτό αποδίδει το κυκλικό προϊόν έξι άνθρακα.
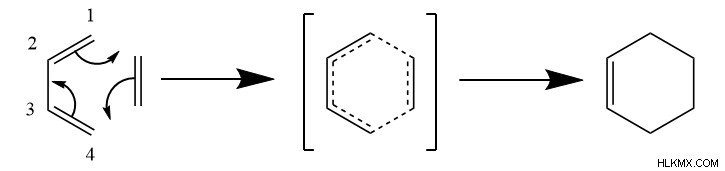
Όπως μπορούμε να δούμε, η αντίδραση συνδέει δύο δεσμούς pi που έχουν σπάσει και δύο δεσμούς σίγμα σχηματίζονται. Επειδή οι δεσμοί σίγμα έχουν χαμηλότερη ενέργεια από τους δεσμούς pi, αυτό σημαίνει ότι η αντίδραση Diels-Alder είναι εξώθερμη. Ωστόσο, η αντίδραση έχει επίσης αρνητική αλλαγή στην εντροπία, γενικά, επειδή μόνο ένα προϊόν σχηματίζεται από δύο αντιδρώντα. Θερμοδυναμικά, αυτό σημαίνει ότι η ενθαλπία οδηγεί την αντίδραση Diels-Alder.
Κινητικά, το Diels-Alder τείνει να προχωρά αργά, λόγω της ακριβούς θέσης των αντιδρώντων που απαιτούνται για το σχηματισμό μεταβατικής κατάστασης. Αυτό έχει ως αποτέλεσμα μια εξαιρετικά αρνητική αλλαγή στην εντροπία του σχηματισμού μεταβατικής κατάστασης.
Όπως φαίνεται παραπάνω, το Diels-Alder δεν απαιτεί καταλύτη οξέος ή βάσης, πράγμα που σημαίνει ότι μια ποικιλία μη ακραίων συνθηκών pH είναι αποδεκτές για την αντίδραση.
Αντίδραση Diels-Alder Τοπική επιλεκτικότητα
Ο γενικός μηχανισμός παραπάνω υποδηλώνει ότι το διενόφιλο μπορεί να έχει οποιαδήποτε θέση σε σχέση με το διένιο, εφόσον ο ένας άνθρακας συνδέεται με τον άνθρακα 1 στο διένιο και ο άλλος άνθρακας αλληλεπιδρά με το 4. Αυτό ισχύει όταν είτε το διένιο είτε το διενόφιλο είναι ένα μεσο ένωση (δηλ. όταν κάποιο από τα αντιδρώντα είναι συμμετρικό).
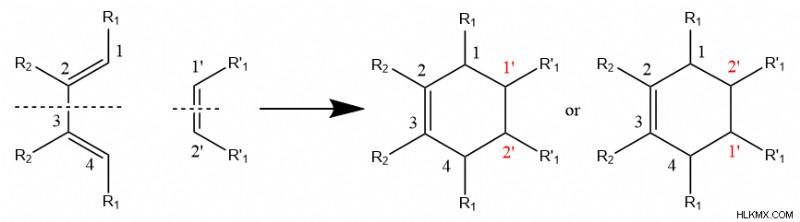
Ωστόσο, όταν τόσο το διένιο όσο και το διενόφιλο στερούνται συμμετρίας, η αντίδραση ευνοεί ορισμένους προσανατολισμούς του διενίου σε σχέση με το διενόφιλο, λόγω του ότι ορισμένες περιοχές των αντιδρώντων έχουν υψηλότερη αντιδραστικότητα από άλλες. Οι χημικοί αποκαλούν αυτό το φαινόμενο «περιοχική επιλεκτικότητα».
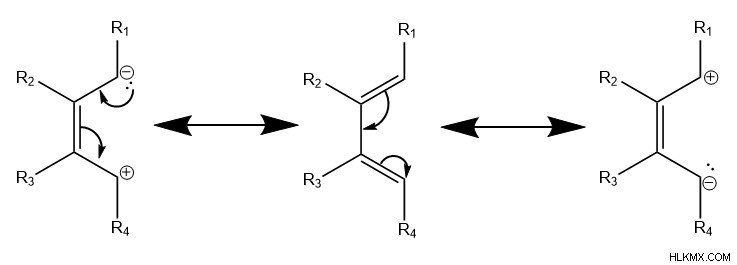
Τόσο στο διένιο όσο και στο διενόφιλο, η τοποθέτηση ομάδων πλούσιων σε ηλεκτρόνια όπως οι αμίνες ή ομάδων φτωχών σε ηλεκτρόνια όπως τα καρβοξυλικά οξέα επηρεάζει τις μορφές συντονισμού του μορίου. Αυτές οι μορφές συντονισμού τοποθετούν μερικά θετικά ή αρνητικά φορτία στους άνθρακες στα άκρα του μορίου.
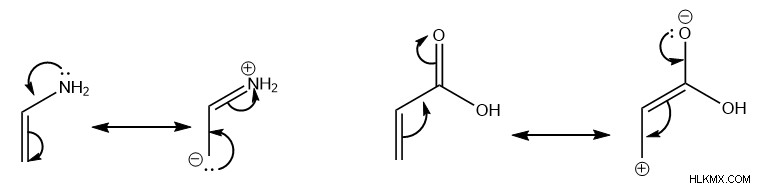

Συγκεκριμένα, αυτή η αλλαγή στην κατανομή ηλεκτρονίων του μορίου είναι αυτή που επηρεάζει την περιφερειακή αντιδραστικότητα, ευνοώντας ως αποτέλεσμα διαφορετικά προϊόντα. Για να επιτραπεί καλύτερα στα ηλεκτρόνια pi να κινούνται κυκλικά για να υποστούν την αντίδραση Diels-Alder, οι μερικώς θετικοί άνθρακες από το διένιο ευνοούν το σχηματισμό δεσμών σίγμα με περισσότερους αρνητικούς άνθρακες του διενόφιλου και αντίστροφα.
Diels-Alder με παρόμοιες ομάδες
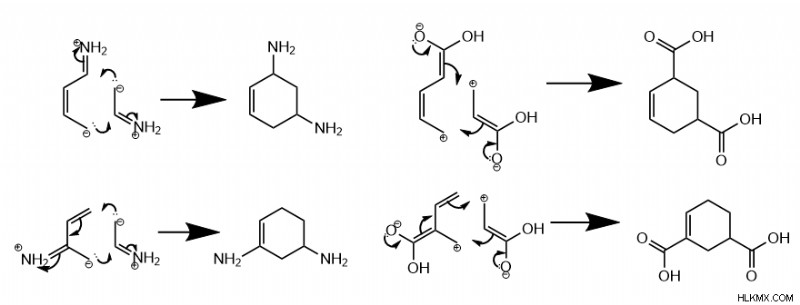
Είναι ενδιαφέρον ότι όταν και τα δύο αντιδρώντα έχουν μία ομάδα πλούσια σε ηλεκτρόνια ή μία φτωχή σε ηλεκτρόνια ομάδα, η αντίδραση ευνοεί το μετα προϊόν. Μετα , σε αυτό το πλαίσιο, σημαίνει ότι οι ομάδες εντοπίζουν δύο άνθρακες μακριά ο ένας από τον άλλο.
Diels-Alder με διαφορετικές ομάδες
Επιπλέον, όταν ένα μόριο έχει μια ομάδα πλούσια σε ηλεκτρόνια ενώ το άλλο έχει μια ομάδα φτωχή σε ηλεκτρόνια, η αντίδραση ευνοεί είτε την παρά προϊόν, όπου οι ομάδες τοποθετούνται αντίθετα, ή το ortho προϊόν, όπου οι ομάδες τοποθετούνται παρακείμενα. Ο σχηματισμός της παρά έναντι όρθο Το προϊόν εξαρτάται από το αν η ομάδα διενίου βρίσκεται σε εξωτερικό άνθρακα (1 ή 4) ή σε εσωτερικό άνθρακα (2 ή 3).
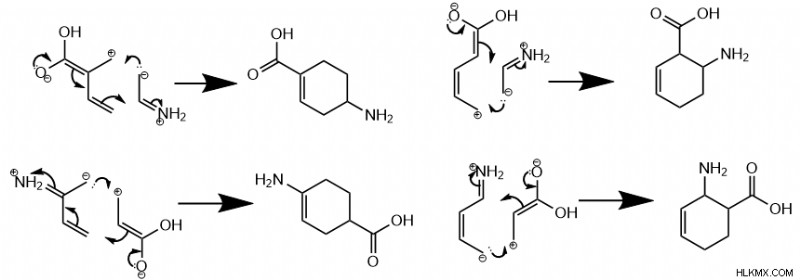
Για διένια και διενόφιλα με πολλαπλές συνδεδεμένες ομάδες, η τοποεπιλεκτικότητα του Diels-Alder εξαρτάται από τις μορφές συντονισμού του μορίου.
Εναλλακτικές αντιδράσεις Diels-Alder
Από τότε που ανακαλύφθηκε η αντίδραση Diels-Alder από τους Γερμανούς χημικούς Otto Diels και Kurt Alder το 1928, ο μηχανισμός έχει αποδειχθεί ευέλικτος για μεταγενέστερους χημικούς. Κατά συνέπεια, μεταγενέστεροι χημικοί έχουν περιγράψει και εφαρμόσει πολλές παραλλαγές του Diels-Alder. Μερικά παραδείγματα περιλαμβάνουν τον σχηματισμό ετεροκυκλικών μορίων, που έχουν ως μέλος δακτυλίου ένα άτομο μη άνθρακα, τον οποίο οι χημικοί κάνουν χρησιμοποιώντας αντιδράσεις Imine-Diels-Alder (IDA) ή Oxo-Diels-Alder (ODA).

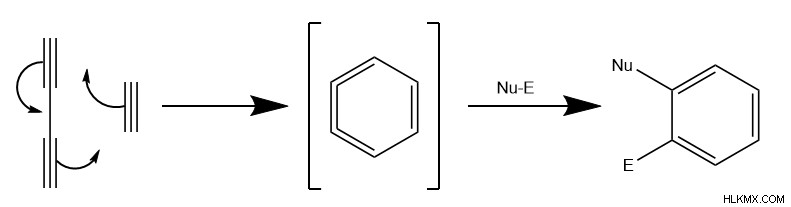
Η αντίδραση Hexadehydro-Diels-Alder (HDDA) αντιπροσωπεύει μια άλλη κοινή παραλλαγή, όπου αντί για διπλούς δεσμούς, τα μόρια των αντιδραστηρίων έχουν τριπλούς δεσμούς. Ο μηχανισμός ακολουθεί την ίδια κυκλική κίνηση των ηλεκτρονίων, σχηματίζοντας αυτό που οι χημικοί αποκαλούν ενδιάμεσο βενζίνης. Στη συνέχεια, μια ένωση με πυρηνόφιλα και ηλεκτρόφιλα συστατικά εκτελεί μια αντίδραση προσθήκης κατά μήκος του τελικού τριπλού δεσμού. Κατά συνέπεια, το HDDA σχηματίζει ένα αρωματικό μόριο. Ωστόσο, λόγω της ιδιόμορφης μοριακής γεωμετρίας του μηχανισμού, η αντίδραση συχνά απαιτεί έναν καταλύτη μετάλλου μεταπτώσεως.