Διαφορά μεταξύ της αρχής Aufbau και του κανόνα του Hund
Κύρια διαφορά – Αρχή Aufbau εναντίον Κανόνα του Hund
Η ανάπτυξη της ατομικής δομής ξεκίνησε με τη σύγχρονη ατομική θεωρία του Dalton. Δήλωσε ότι όλη η ύλη αποτελείται από άτομα και τα άτομα δεν μπορούν να χωριστούν περαιτέρω σε μικρότερα σωματίδια. Ωστόσο, αργότερα διαπιστώθηκε ότι το άτομο μπορεί να διαιρεθεί περαιτέρω σε υποατομικά σωματίδια μετά την ανακάλυψη του ηλεκτρονίου από τον J.J. Thompson, η ανακάλυψη του πυρήνα από τον Rutherford και η έννοια των τροχιακών ηλεκτρονίων του Niels Bohr. Η δομή του ατόμου που είναι αποδεκτή επί του παρόντος περιλαμβάνει λεπτομέρειες σχετικά με τα κελύφη ηλεκτρονίων, τα υποκέλυφα και τα τροχιακά. Ο τρόπος με τον οποίο γεμίζουν τα ηλεκτρόνια σε αυτά τα κελύφη και τα τροχιακά μπορεί να περιγραφεί χρησιμοποιώντας την αρχή Aufbau και τον κανόνα του Hund. Η κύρια διαφορά μεταξύ της Αρχής του Aufbau και του Κανόνα του Hund είναι ότι η Αρχή Aufbau υποδεικνύει τη σειρά με την οποία τα υποκέλυφα γεμίζουν με ηλεκτρόνια, ενώ ο κανόνας του Hund υποδεικνύει τη σειρά με την οποία τα τροχιακά των υποκεφύλων είναι γεμάτα ηλεκτρόνια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Αρχή Aufbau
– Θεωρία, Εξήγηση με Παραδείγματα
2. Τι είναι ο Κανόνας του Hund
– Θεωρία, Εξήγηση με Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ της αρχής Aufbau και του κανόνα του Hund
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ της αρχής Aufbau και του κανόνα του Hund
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Atom, Aufbau Principle, Electron, Hund's Rule, Orbital 
Τι είναι η Αρχή Aufbau
Η αρχή του Aufbau δηλώνει ότι η σειρά πλήρωσης των ηλεκτρονίων στα υποφλοιώματα ενός ατόμου εμφανίζεται από το χαμηλότερο επίπεδο ενέργειας έως το υψηλότερο ενεργειακό επίπεδο. Με άλλα λόγια, όταν τα ηλεκτρόνια γεμίζουν στα τροχιακά ενός ατόμου, τα ηλεκτρόνια γεμίζουν πρώτα τα τροχιακά που βρίσκονται στο χαμηλότερο ενεργειακό επίπεδο πριν γεμίσουν τα υψηλά ενεργειακά επίπεδα.
Γενικά, η ενέργεια αυξάνεται της τάξης του 1 <2 <3 <4 στο επίπεδο του κελύφους και s
Αναμενόμενη παραγγελία
1s <2s <3s <3p <3d <4s <4p <4d <5s…
Πραγματική παραγγελία
1s <2s <3s <3p <4s <3d <4p <5s <4η…
Ωστόσο, είναι δύσκολο να θυμηθούμε τα ενεργειακά επίπεδα κάθε τροχιακού ένα προς ένα. Επομένως, μπορούμε να χρησιμοποιήσουμε το παρακάτω διάγραμμα για να προσδιορίσουμε εύκολα τα επίπεδα ενέργειας.
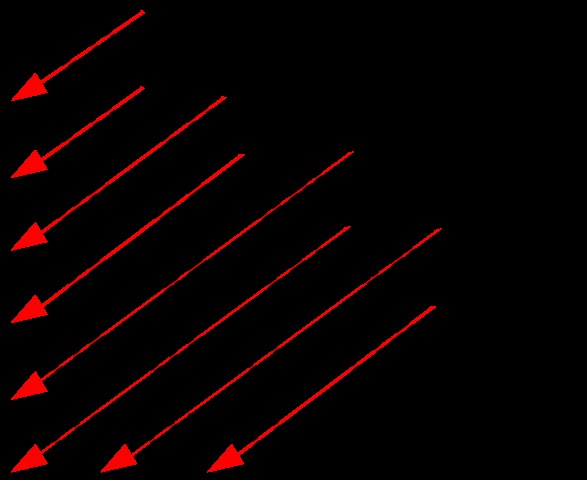
Εικόνα 1:Σειρά των ενεργειακών επιπέδων των τροχιακών
Η παραπάνω εικόνα δείχνει ένα διάγραμμα για τον προσδιορισμό των επιπέδων ενέργειας. Εδώ, μπορούμε να λάβουμε τη σειρά των τροχιακών ακολουθώντας τη διαδρομή των βελών. Μετά από κάθε κεφαλή βέλους, ξεκινήστε με το επόμενο βέλος. Με αυτόν τον τρόπο, είναι εύκολο να αποκτήσετε τα επίπεδα ενέργειας.
Τι είναι ο κανόνας του Χουντ
Ο κανόνας του Χουντ εξηγεί τη σειρά των ηλεκτρονίων που γεμίζουν στα τροχιακά των υποφλοιών. Τα υποκελύφη αποτελούνται από τροχιακά. Ο αριθμός των τροχιακών που υπάρχουν σε ένα υποκέλυφος είναι διαφορετικός από το ένα υποκέλυφος στο άλλο. Για παράδειγμα, το s υποκέλυφος έχει μόνο ένα s-τροχιακό, το p υποκέλυφος έχει 3 p-τροχιακά και το d υποκέλυφος αποτελείται από 5 d-τροχιακά. Έτσι, θα πρέπει να υπάρχει μια σειρά πλήρωσης αυτών των τροχιακών με ηλεκτρόνια. Διαφορετικά, αυτά τα άτομα γίνονται ασταθή.
Ένα τροχιακό μπορεί να χωρέσει το πολύ 2 ηλεκτρόνια. Σύμφωνα με τον κανόνα του Hund, κάθε τροχιακό στο ίδιο υποκέλυφος καταλαμβάνεται πρώτα μεμονωμένα από ηλεκτρόνια πριν ζευγαρώσουν. Αυτό σημαίνει ότι τα ηλεκτρόνια αρχικά γεμίζονται ως μη ζευγαρωμένα ηλεκτρόνια και στη συνέχεια συζευγνύονται. Επομένως, κατά την αντιστοίχιση ηλεκτρονίων σε τροχιακά, ακολουθείται αυτός ο κανόνας. Αυτό οφείλεται στο ότι, εάν υπάρχουν τροχιακά με ζεύγη ηλεκτρονίων και κενά τροχιακά στο ίδιο υποκέλυφος, είναι ασταθής διαμόρφωση αφού τα ηλεκτρόνια είναι αρνητικά φορτισμένα και απωθούνται μεταξύ τους όταν βρίσκονται στο ίδιο τροχιακό. Επομένως, τα ηλεκτρόνια τείνουν να διατάσσονται με τέτοιο τρόπο ώστε η απώθηση μεταξύ των ηλεκτρονίων να ελαχιστοποιείται.
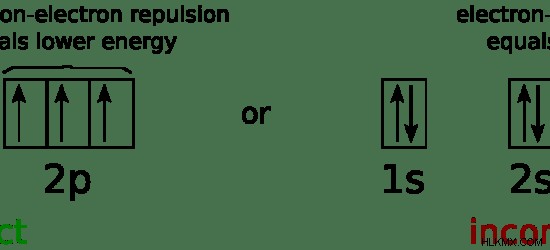
Εικόνα 2:Ηλεκτρόνια που καταλαμβάνουν τροχιακά
Επιπλέον, αυτός ο κανόνας εξηγεί ότι τα ηλεκτρόνια γεμίζονται στα τροχιακά με τέτοιο τρόπο ώστε να ταιριάζουν με το «σπιν» τους. Με άλλα λόγια, τα ηλεκτρόνια σε μεμονωμένα κατειλημμένα τροχιακά του ίδιου υποστυλώματος έχουν το ίδιο σπιν. Όταν αυτά τα ηλεκτρόνια ζευγαρώνονται, δύο ηλεκτρόνια έχουν αντίθετα σπιν προκειμένου να ελαχιστοποιηθεί η απώθηση μεταξύ τους. Ένα ηλεκτρόνιο του ζεύγους ηλεκτρονίων «σπιν-επάνω» ενώ το άλλο ηλεκτρόνιο «σπιν-κάτω».

Εικόνα 3:Σπιν ηλεκτρονίων σε τροχιακά
Αν ένα τροχιακό είναι κατειλημμένο μεμονωμένα, αυτό το ηλεκτρόνιο μπορεί να είναι είτε "spin-up" ή "spin-down". Ωστόσο, όταν αυτό το ηλεκτρόνιο είναι ζευγαρωμένο, το άλλο ηλεκτρόνιο θα πρέπει να έχει το αντίθετο σπιν από αυτό το ηλεκτρόνιο. Έτσι ελαχιστοποιείται η απώθηση.
Ομοιότητες μεταξύ της αρχής Aufbau και του κανόνα Hund
- Τόσο η αρχή Aufbau όσο και ο κανόνας του Hund υποδεικνύουν τη σειρά με την οποία τα ενεργειακά επίπεδα ενός ατόμου γεμίζουν με ηλεκτρόνια.
Διαφορά μεταξύ της αρχής Aufbau και του κανόνα του Hund
Ορισμός
Αρχή Aufbau: Η αρχή Aufbau εξηγεί τη σειρά με την οποία τα υποκέλυφα ενός ατόμου γεμίζουν με ηλεκτρόνια.
Κανόνας του Χουντ: Ο κανόνας του Hund εξηγεί τη σειρά με την οποία τα τροχιακά των υποκεφύλων γεμίζουν ηλεκτρόνια.
Θεωρία
Αρχή Aufbau: Σύμφωνα με την αρχή Aufbau, τα υποκέλυφα γεμίζονται από το χαμηλότερο επίπεδο ενέργειας έως το υψηλότερο επίπεδο ενέργειας.
Κανόνας του Χουντ: Σύμφωνα με τον κανόνα του Hund, τα τροχιακά καταλαμβάνονται πρώτα μεμονωμένα από ηλεκτρόνια και μετά ζευγαρώνονται ανάλογα με τα σπιν τους.
Επίπεδα ενέργειας
Αρχή Aufbau: Η αρχή Aufbau περιγράφει τον τρόπο με τον οποίο τα ηλεκτρόνια γεμίζουν τα υποφλοιώματα.
Κανόνας του Χουντ: Ο κανόνας του Hund περιγράφει τον τρόπο με τον οποίο τα ηλεκτρόνια γεμίζουν τα τροχιακά των υποφλοιών.
Αποκρούσεις
Αρχή Aufbau: Η αρχή Aufbau δεν περιγράφει την ελαχιστοποίηση των απωθήσεων μεταξύ των ηλεκτρονίων.
Κανόνας του Χουντ: Ο κανόνας του Hund υποδεικνύει πώς γεμίζονται τα ηλεκτρόνια με τρόπο που ελαχιστοποιεί τις απωθήσεις μεταξύ των ηλεκτρονίων.
Συμπέρασμα
Τόσο η αρχή Aufbau όσο και ο κανόνας του Hund είναι πολύ σημαντικά για την ανάπτυξη της ατομικής δομής ενός συγκεκριμένου ατόμου. Εάν ο αριθμός των ηλεκτρονίων είναι γνωστός για ένα συγκεκριμένο άτομο, τότε μπορούμε να προσδιορίσουμε το σχέδιο που αυτά τα ηλεκτρόνια είναι διατεταγμένα σε αυτό το άτομο με τη χρήση των παραπάνω θεωριών. Η κύρια διαφορά μεταξύ της αρχής Aufbau και του κανόνα του Hund είναι ότι η αρχή Aufbau υποδεικνύει τη σειρά με την οποία γεμίζουν τα υποκέλυφα με ηλεκτρόνια, ενώ ο κανόνας του Hund υποδεικνύει τον τρόπο με τον οποίο τα ηλεκτρόνια γεμίζουν τα τροχιακά στα υποκελύφη.




