Διαφορά μεταξύ μονοατομικών και πολυατομικών ιόντων
Κύρια διαφορά – Μονατομικά έναντι πολυατομικών ιόντων
Οι όροι μονοατομικός και πολυατομικός περιγράφουν την ατομικότητα μορίων ή ιόντων. Ατομικότητα είναι ο αριθμός των ατόμων που υπάρχουν σε ένα μόριο ή ένα ιόν. Αυτή είναι η κύρια διαφορά μεταξύ μονοατομικών και πολυατομικών ιόντων.Τα μονοατομικά ιόντα αποτελούνται από ένα μόνο άτομο ενώ τα πολυατομικά ιόντα αποτελούνται από δύο ή περισσότερα άτομα ανά ιόν . Αυτά τα ιόντα μπορεί να είναι είτε κατιόντα είτε ανιόντα. Τόσο τα μονοατομικά όσο και τα πολυατομικά ιόντα μπορούν να σχηματίσουν ιοντικές ενώσεις έχοντας ηλεκτροστατικές έλξεις με τα ιόντα αντίθετου ηλεκτρικού φορτίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Μονατομικά Ιόντα
– Ορισμός, Σχηματισμός, Παραδείγματα
2. Τι είναι τα Πολυατομικά Ιόντα
– Ορισμός, Σχηματισμός, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Μονατομικών και Πολυατομικών Ιόντων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ανιόν, Ατομικότητα, Κατιόν, Ομοιοπολικός δεσμός, Ηλεκτροστατικές έλξεις, Στοιχείο, Ιόν, Μονατομικά ανιόντα, Μονατομικά Κατιόντα, Μονατομικά Ιόντα, Πολυατομικά Ιόντα

Τι είναι τα Μονατομικά Ιόντα
Τα μονοατομικά ιόντα είναι ιόντα που περιέχουν ένα άτομο ανά ιόν. Αυτά μπορεί να είναι είτε κατιόντα είτε ανιόντα. Μερικά άτομα σχηματίζουν ιόντα αφαιρώντας ηλεκτρόνια σθένους από το εξώτατο κέλυφος ηλεκτρονίων τους. Αυτά τα ιόντα είναι μονατομικά κατιόντα . Ορισμένα ιόντα σχηματίζονται με την απόκτηση ηλεκτρονίων στο εξώτατο κέλυφος ηλεκτρονίων. Αυτά είναι γνωστά ως μονατομικά ανιόντα . Ο παρακάτω πίνακας δείχνει τα μονοατομικά ιόντα που σχηματίζονται από στοιχεία της ομάδας 1 και της ομάδας 17.
| Μονατομικά κατιόντα | Μονατομικά κατιόντα |
| Li | F |
| Na | Cl |
| K | Br |
| Cs | I |
Ορισμένα στοιχεία μπορούν να σχηματίσουν μόνο μονοατομικά ιόντα. Αλλά και άλλα στοιχεία μπορούν να σχηματίσουν πολυατομικά ιόντα. Τα μονοατομικά ιόντα μπορούν να έχουν διαφορετικά ηλεκτρικά φορτία ανάλογα με τον αριθμό των ηλεκτρονίων σθένους που έχουν. Για παράδειγμα, το μαγνήσιο (Mg) είναι στοιχείο της ομάδας 2 και έχει δύο ηλεκτρόνια σθένους. Αφαιρώντας αυτά τα δύο ηλεκτρόνια, το Mg μπορεί να σχηματίσει κατιόν Mg. Τότε είναι ένα μονοατομικό κατιόν. Αλλά τα ευγενή αέρια δεν έχουν ποτέ μονοατομικά ιόντα, καθώς τα άτομά τους είναι πολύ σταθερά με μια ολοκληρωμένη ηλεκτρονική διαμόρφωση.
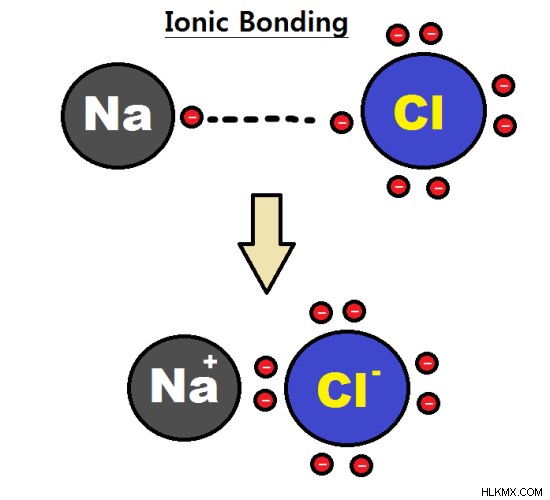
Εικόνα 1:Ο ιοντικός δεσμός μεταξύ δύο μονοατομικών ιόντων σχηματίζει ένα διατομικό μόριο
Ο δεσμός μεταξύ δύο μονοατομικών ιόντων με αντίθετα φορτία μπορεί να σχηματίσει ένα διατομικό μόριο. Εδώ, το κατιόν και το ανιόν έλκονται μεταξύ τους μέσω ηλεκτροστατικών δυνάμεων. Για παράδειγμα, το χλωριούχο νάτριο (NaCl) αποτελείται από μονοατομικό κατιόν νατρίου και χλωριούχο μονοατομικό ανιόν.
Τι είναι τα Πολυατομικά Ιόντα
Τα πολυατομικά ιόντα είναι ιόντα που αποτελούνται από πολλά άτομα ανά ιόν. Μπορούν να είναι είτε διατομικά ιόντα, τριατομικά ιόντα και αντίστροφα. Υπάρχει ένας αμέτρητος αριθμός γνωστών πολυατομικών ιόντων. Μερικά από αυτά υπάρχουν στο βιολογικό σύστημα. Μερικά είναι φυσικά ιόντα ενώ άλλα είναι συνθετικά ιόντα. Είναι πολύ χρήσιμα πολυατομικά ιόντα.
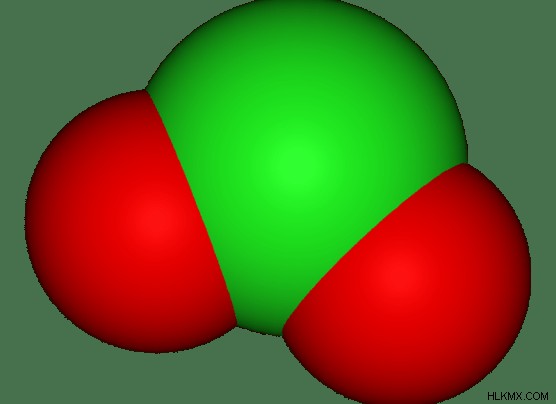
Εικόνα 2:Τριατομικό ιόν
Τα άτομα στο πολυατομικό ιόν είναι ομοιοπολικά συνδεδεμένα μεταξύ τους. Μπορεί να υπάρχουν δεσμοί σίγμα καθώς και δεσμοί pi. Μερικές φορές, ένα πολυατομικό ιόν σχηματίζεται ως σύμπλοκο συντονισμού. Εδώ, ένα κεντρικό μέταλλο περιβάλλεται από ουδέτερα φορτισμένους συνδετήρες. Αυτοί οι συνδέτες συνδέονται με το κεντρικό μεταλλικό ιόν μέσω ομοιοπολικών δεσμών συντεταγμένων. Τότε το σύμπλοκο θεωρείται ως μιγαδικό ιόν. Το ηλεκτρικό φορτίο αυτού του ιόντος είναι το φορτίο του κεντρικού μεταλλικού ιόντος.
Εκτός αυτού, υπάρχουν εκατοντάδες πολυατομικά ιόντα. Μπορούν να είναι είτε κατιόντα είτε ανιόντα ανάλογα με το συνολικό φορτίο του ιόντος. Ο παρακάτω πίνακας δίνει μερικά από αυτά.
| Πολυατομικά κατιόντα | Πολυατομικά ανιόντα |
| NH4 | CO3 |
| H3 O | ΟΧΙ2 |
| [Co(H2 O)6 ] | CN |
| [Co(NH3 )6 ] | HSO4 |
| [Ni(H2 O)6 ] | ClO4 |
Διαφορά μεταξύ Μονατομικών και Πολυατομικών ιόντων
Ορισμός
Μονατομικά ιόντα: Τα μονοατομικά ιόντα είναι ιόντα που περιέχουν ένα άτομο ανά ιόν.
Πολυατομικά ιόντα: Τα πολυατομικά ιόντα είναι ιόντα που αποτελούνται από πολλά άτομα ανά ιόν.
Αριθμός ατόμων
Μονατομικά ιόντα: Τα μονοατομικά ιόντα αποτελούνται από ένα άτομο ανά ιόν.
Πολυατομικά ιόντα: Τα πολυατομικά ιόντα αποτελούνται από πολλά άτομα ανά ιόν.
Σχηματισμός
Μονατομικά ιόντα: Τα μονοατομικά ιόντα σχηματίζονται είτε χάνοντας είτε κερδίζοντας ηλεκτρόνια στο πιο εξωτερικό κέλυφος ενός ατόμου.
Πολυατομικά ιόντα: Τα πολυατομικά ιόντα σχηματίζονται συνδέοντας πολλά άτομα μεταξύ τους μέσω ομοιοπολικών δεσμών ή συντεταγμένων ομοιοπολικών δεσμών.
Χημικός δεσμός
Μονατομικά ιόντα: Δεν υπάρχουν χημικοί δεσμοί στα μονοατομικά ιόντα.
Πολυατομικά ιόντα: Υπάρχουν ομοιοπολικοί ή συντεταγμένοι ομοιοπολικοί δεσμοί σε πολυατομικά ιόντα.
Παραδείγματα
Μονατομικά ιόντα: Παραδείγματα για μονοατομικά ιόντα περιλαμβάνουν Na, K, Cl, κ.λπ.
Πολυατομικά ιόντα: Παραδείγματα πολυατομικών ιόντων περιλαμβάνουν το NH4 , ΟΧΙ2 , ΟΧΙ3 , κ.λπ.
Συμπέρασμα
Τα μονοατομικά ιόντα και τα πολυατομικά ιόντα ονομάζονται σύμφωνα με τον αριθμό των ατόμων που υπάρχουν σε αυτά τα ιόντα. Η κύρια διαφορά μεταξύ μονοατομικών και πολυατομικών ιόντων είναι ότι τα μονοατομικά ιόντα αποτελούνται από μεμονωμένα άτομα ενώ τα πολυατομικά ιόντα αποτελούνται από δύο ή περισσότερα άτομα ανά ιόν.




