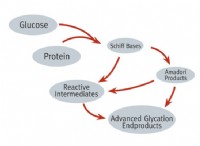
Πώς διαφέρουν τα εξωτερικά ηλεκτρόνια σε μεταλλικά άτομα από μη μέταλλα άτομα;
Μέταλλα άτομα:
* Χαλαρά δεσμευμένα: Τα εξωτερικά ηλεκτρόνια, γνωστά ως ηλεκτρόνια σθένους, συνδέονται χαλαρά με τον πυρήνα. Αυτό σημαίνει ότι μπορούν εύκολα να αποσπάσουν και να κινηθούν ελεύθερα σε όλη τη μεταλλική δομή.
* Θάλασσα ηλεκτρονίων: Αυτά τα ηλεκτρόνια ελεύθερης μετακίνησης δημιουργούν μια "θάλασσα ηλεκτρονίων" που περιβάλλει τα θετικά φορτισμένα μεταλλικά ιόντα. Αυτή η "θάλασσα" είναι υπεύθυνη για πολλές από τις μοναδικές ιδιότητες των μετάλλων, όπως η αγωγιμότητα και η ευελιξία.
* Delocalized: Τα ηλεκτρόνια σθένους δεν σχετίζονται με ένα συγκεκριμένο άτομο, αλλά μοιράζονται σε όλο το μεταλλικό πλέγμα.
* LOST: Τα μεταλλικά άτομα τείνουν να χάνουν τα ηλεκτρόνια σθένους τους, σχηματίζοντας θετικά ιόντα (κατιόντα).
Μη μεταλλάκια:
* Στερεά δεσμευμένο: Τα μη μεταλλικά άτομα έχουν τα ηλεκτρόνια σθένους τους στενά συνδεδεμένα με τον πυρήνα. Δεν αποσπώνται ή μοιράζονται εύκολα.
* εντοπισμός: Αυτά τα ηλεκτρόνια συνδέονται ειδικά με τα αντίστοιχα άτομα τους, που δεν μοιράζονται με άλλους.
* Κερδίστε ηλεκτρόνια: Τα μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων, σχηματίζοντας αρνητικά ιόντα (Anions).
Εδώ είναι ο τρόπος με τον οποίο αυτές οι διαφορές επηρεάζουν τις ιδιότητες των μετάλλων και των μη μεταλλικών:
* αγωγιμότητα: Τα ηλεκτρόνια ελεύθερης μετακίνησης σε μέταλλα τους επιτρέπουν να διεξάγουν ηλεκτρική ενέργεια και να θερμαίνουν εύκολα. Τα μη μέταλλα, με τα στενά δεσμευμένα ηλεκτρόνια τους, είναι κακοί αγωγοί.
* Μαλλιδικότητα και ολκιμότητα: Η θάλασσα των ηλεκτρονίων σε μέταλλα επιτρέπει στα μεταλλικά ιόντα να γλιστρούν μεταξύ τους χωρίς να σπάσουν τη δομή, οδηγώντας σε ευελιξία (ικανότητα να σφυρηλατηθεί σε φύλλα) και ολκιμότητα (ικανότητα να ληφθεί σε καλώδια). Τα μη μέταλλα είναι γενικά εύθραυστα και σπάζουν εύκολα.
* λάμψη: Τα ελεύθερα ηλεκτρόνια στα μέταλλα αντικατοπτρίζουν το φως, δίνοντάς τους μια λαμπερή εμφάνιση (μεταλλική λάμψη). Τα μη μέταλλα δεν έχουν αυτό το χαρακτηριστικό.
* Χημική σύνδεση: Τα μέταλλα τείνουν να σχηματίζουν ιοντικούς δεσμούς χάνοντας ηλεκτρόνια σε μη μέταλλα. Τα μη μέταλλα σχηματίζουν ομοιοπολικούς δεσμούς με την κοινή χρήση ηλεκτρονίων με άλλα μη μέταλλα.
Συνοπτικά: Η βασική διαφορά έγκειται στην κινητικότητα και τη δέσμευση της δύναμης των ηλεκτρονίων σθένους. Τα μεταλλικά άτομα έχουν χαλαρά δεσμευμένα, απομακρυσμένα ηλεκτρόνια, ενώ τα μη μεταλλικά άτομα έχουν στενά συνδεδεμένα, εντοπισμένα ηλεκτρόνια. Αυτή η θεμελιώδης διαφορά οδηγεί σε πολύ διαφορετικές φυσικές και χημικές ιδιότητες.