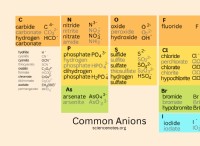
Τι είδους στοιχεία συμμετέχουν σε ιοντικό δεσμό;
* Ηλεκτροργατιστικότητα: Αυτό είναι το μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό.
* Μεγάλες διαφορές: Όταν ένα άτομο έχει πολύ υψηλότερη ηλεκτροαρνητικότητα από το άλλο, τραβά τα κοινόχρηστα ηλεκτρόνια πιο κοντά στον εαυτό του. Αυτό έχει ως αποτέλεσμα ένα άτομο να γίνει αρνητικά φορτισμένο (ανιόν) και το άλλο να γίνει θετικά φορτισμένο (κατιόν).
Συγκεκριμένα, οι ιοντικοί δεσμοί συνήθως εμφανίζονται μεταξύ:
* Μέταλλα και μη μέταλλα: Τα μέταλλα τείνουν να έχουν χαμηλή ηλεκτροαρνητικότητα, ενώ τα μη μέταλλα έχουν υψηλή ηλεκτροαρνητικότητα. Αυτό δημιουργεί μια σημαντική διαφορά στην έλξη τους για τα ηλεκτρόνια.
Παραδείγματα:
* Χλωριούχο νάτριο (NaCl): Το νάτριο (Na) είναι ένα μέταλλο, ενώ το χλώριο (CL) είναι μη μέταλλο. Το χλώριο έχει πολύ υψηλότερη ηλεκτροαρνητικότητα και προσελκύει τα κοινόχρηστα ηλεκτρόνια, σχηματίζοντας ένα αρνητικό ιόν χλωριδίου (Cl-). Το νάτριο χάνει το ηλεκτρόνιο του και γίνεται ένα θετικό ιόν νατρίου (Na+). Η ηλεκτροστατική έλξη μεταξύ αυτών των αντίθετα φορτισμένων ιόντων αποτελεί τον ιονικό δεσμό.
* οξείδιο μαγνησίου (MGO): Το μαγνήσιο (mg) είναι ένα μέταλλο και το οξυγόνο (Ο) είναι μη μέταλλο. Το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα, προσελκύοντας τα κοινόχρηστα ηλεκτρόνια και σχηματίζοντας αρνητικό ιόν οξειδίου (Ο2-). Το μαγνήσιο χάνει τα ηλεκτρόνια του και γίνεται θετικό ιόν μαγνησίου (Mg2+). Και πάλι, η ηλεκτροστατική έλξη συγκρατεί τα ιόντα μαζί.