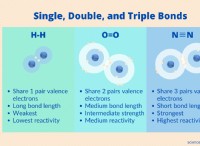
Γιατί οι ομοιοπολικές ενώσεις είναι πτητικές;
Τι είναι η μεταβλητότητα;
Η μεταβλητότητα αναφέρεται στην τάση μιας ουσίας να εξατμίζεται ή να εξατμίζεται σε μια δεδομένη θερμοκρασία. Όσο ευκολότερη εξατμίζεται μια ουσία, τόσο πιο ασταθής είναι.
Γιατί είναι μερικές ομοιοπολικές ενώσεις πτητικές;
* αδύναμες διαμοριακές δυνάμεις: Οι ομοιοπολικές ενώσεις έχουν γενικά ασθενέστερες ενδομοριακές δυνάμεις (δυνάμεις μεταξύ μορίων) σε σύγκριση με ιοντικές ενώσεις. Αυτό οφείλεται στο γεγονός ότι η κατανομή των ηλεκτρονίων σε ομοιοπολικούς δεσμούς οδηγεί σε σχετικά ασθενέστερα αξιοθέατα μεταξύ των μορίων.
* χαμηλή μοριακή μάζα: Τα μικρότερα μόρια με χαμηλότερες μοριακές μάζες τείνουν να είναι πιο πτητικές επειδή έχουν λιγότερη κινητική ενέργεια για να ξεπεράσουν τις ασθενέστερες διαμοριακές δυνάμεις.
Γιατί μερικές ομοιοπολικές ενώσεις δεν είναι πτητικές;
* ισχυρότερες διαμοριακές δυνάμεις: Ορισμένες ομοιοπολικές ενώσεις έχουν ισχυρότερες ενδομοριακές δυνάμεις όπως η δέσμευση υδρογόνου, οι οποίες μπορούν να αυξήσουν σημαντικά το σημείο βρασμού τους και να τους κάνουν λιγότερο ασταθές. Το νερό είναι ένα εξαιρετικό παράδειγμα αυτού.
* Μεγάλη μοριακή μάζα: Ακόμη και με αδύναμες ενδομοριακές δυνάμεις, τα μεγαλύτερα μόρια με υψηλής μοριακής μάζας έχουν μεγαλύτερη τάση να παραμένουν στην υγρή ή στερεά κατάσταση λόγω του τεράστιου μεγέθους και του αριθμού των εμπλεκόμενων ατόμων.
Παραδείγματα:
* πτητικά: Μεθάνιο (CH4), αιθανόλη (C2H5OH), διοξείδιο του άνθρακα (CO2) - όλα αυτά είναι μικρά μόρια με αδύναμες διαμοριακές δυνάμεις.
* Μη πτητική: Πολυαιθυλένιο (C2H4) Ν, ζάχαρη (C12H22O11) - αυτά έχουν μεγάλες μοριακές μάζες και μερικές ισχυρότερες διαμοριακές δυνάμεις.
Συνοπτικά:
Η μεταβλητότητα στις ομοιοπολικές ενώσεις εξαρτάται από ένα συνδυασμό των διαμοριακών δυνάμεων και της μοριακής μάζας. Ενώ πολλές ομοιοπολικές ενώσεις είναι πτητικές, είναι σημαντικό να θυμόμαστε ότι η αστάθεια δεν είναι εγγενές χαρακτηριστικό όλων των ομοιοπολικών ενώσεων.