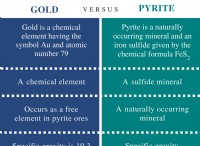
Τι παράγει ένα ιοντικό δεσμό;
* ΚΟΟΔΙΑ: Το μεταλλικό άτομο χάνει ηλεκτρόνια και γίνεται θετικά φορτισμένο.
* Anions: Το μη μέταλλο ατόμων κερδίζει ηλεκτρόνια και γίνεται αρνητικά φορτισμένο.
Οι αντίθετες χρεώσεις των ιόντων στη συνέχεια προσελκύουν ο ένας τον άλλον, σχηματίζοντας τον ιονικό δεσμό.
Ακολουθεί μια ανάλυση της διαδικασίας:
1. Ηλεκτροστατική έλξη: Η ισχυρή ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων τους κρατά μαζί σε μια άκαμπτη δομή πλέγματος.
2. Μεταφορά ηλεκτρονίων: Η βασική διαφορά μεταξύ ιοντικής και ομοιοπολικής σύνδεσης είναι η μεταφορά ηλεκτρονίων. Σε ιοντικούς δεσμούς, το ένα άτομο χάνει εντελώς ηλεκτρόνια, ενώ το άλλο άτομο τα κερδίζει. Αυτό δημιουργεί μια σταθερή διαμόρφωση ηλεκτρονίων και για τα δύο άτομα.
3. Σχηματισμός ιόντων: Η απώλεια ή το κέρδος των ηλεκτρονίων οδηγεί στο σχηματισμό ιόντων. Το μεταλλικό άτομο γίνεται θετικά φορτισμένο κατιόν και το μη μέταλλο άτομο γίνεται ένα αρνητικά φορτισμένο ανιόν.
4. Δομή πλέγματος: Οι ιοντικές ενώσεις σχηματίζουν μια κρυσταλλική δομή πλέγματος, όπου τα ιόντα είναι διατεταγμένα σε ένα επαναλαμβανόμενο μοτίβο. Αυτή η δομή συγκρατείται από τις ισχυρές ηλεκτροστατικές δυνάμεις μεταξύ των ιόντων.
Παράδειγμα:
Το νάτριο (Na), ένα μέταλλο, αντιδρά με χλώριο (CL), μη μέταλλο, για να σχηματίσει χλωριούχο νάτριο (NaCl).
* Το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει ένα ιόν νατρίου (Na+).
* Το χλώριο κερδίζει ένα ηλεκτρόνιο για να γίνει ένα ιόν χλωριούχου (cl-).
* Τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον, σχηματίζοντας ένα ιοντικό δεσμό.
Βασικά σημεία που πρέπει να θυμάστε:
* Οι ιοντικοί δεσμοί σχηματίζονται συνήθως μεταξύ μετάλλων και μη μεταλλικών.
* Η μεταφορά ηλεκτρονίων δημιουργεί ιόντα με αντίθετες χρεώσεις.
* Η ηλεκτροστατική έλξη μεταξύ των ιόντων σχηματίζει έναν ισχυρό δεσμό.
* Οι ιοντικές ενώσεις είναι τυπικά κρυσταλλικά στερεά με υψηλά σημεία τήξης και βρασμού.
* Είναι καλοί αγωγοί ηλεκτρικής ενέργειας όταν διαλύονται σε νερό ή λιωμένο.