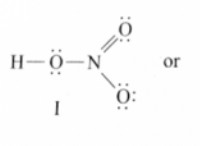
Πόσα γραμμάρια NaCl απαιτούνται για να ουδετερρέση 100ml 1m H2SO4;
1. Κατανοήστε την αντίδραση:
Η αντίδραση μεταξύ του χλωριούχου νατρίου (NaCl) και του θειικού οξέος (H₂so₄) δεν είναι αντίδραση εξουδετέρωσης. Το NaCl είναι ένα αλάτι και δεν θα εξουδετερώσει ένα οξύ.
2. Εξουδετέρωση με βάση:
Για να εξουδετερώσετε το θειικό οξύ, θα χρειαστείτε μια βάση όπως το υδροξείδιο του νατρίου (NAOH). Εδώ είναι η ισορροπημένη χημική εξίσωση για αυτήν την αντίδραση:
H₂so₄ (aq) + 2 naOH (aq) → na₂so₄ (aq) + 2 h₂o (l)
3. Υπολογίστε τα κομμάτια του h₂so₄:
* Molarity (m) =moles (mol) / όγκος (L)
* Έχουμε 100 ml 1 Μ H ₂so₄, που είναι 0,1 L.
* Moles του H₂so₄ =Molarity × Volume =1 m × 0,1 L =0,1 mol mol
4. Υπολογίστε τα moles του NaOH που χρειάζονται:
* Από την ισορροπημένη εξίσωση, 1 mole του h₂so₄ αντιδρά με 2 moles του NaOH.
* Moles του naOH που απαιτείται =0.1 mol h₂so₄ × (2 mol naOH / 1 mol h₂so₄) =0.2 mol naOH
5. Υπολογίστε τα γραμμάρια NaOH που χρειάζονται:
* Μοριακή μάζα NaOH =40 g/mol
* Γραμμάρια NaOH =moles × molar mass =0,2 mol × 40 g/mol =8 g
Ως εκ τούτου, θα χρειαστείτε 8 γραμμάρια υδροξειδίου του νατρίου (NAOH) για να εξουδετερώσετε πλήρως 100 mL θειικού οξέος 1 Μ (H₂SO₄).