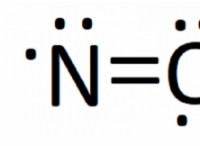Πώς γράφετε τη φόρμουλα για μια ομοιοπολική ένωση και δίνετε παράδειγμα ένωσης;
Γράφοντας τύποι για ομοιοπολικές ενώσεις:
Εδώ είναι πώς να γράψετε τύπους για ομοιοπολικές ενώσεις:
1. Προσδιορίστε τα στοιχεία: Προσδιορίστε τα στοιχεία που υπάρχουν στην ένωση.
2. Προσδιορίστε τα προθέματα: Χρησιμοποιήστε προθέματα για να υποδείξετε τον αριθμό των ατόμων κάθε στοιχείου στο μόριο. Ακολουθεί ένας πίνακας κοινών προθέσεων:
| Πρόθεμα | Αριθμός |
| --- | --- |
| Μονο- | 1 |
| | 2 |
| Τρι-| 3 |
| Τετρά- | 4 |
| Penta- | 5 |
| Εξά- | 6 |
| Επτά- 7 |
| Οκτώβριος | 8 |
| Μη- 9 |
| Deca- | 10 |
3. Γράψτε τον τύπο: Το στοιχείο με την χαμηλότερη ηλεκτροαρνητικότητα γράφεται πρώτα. Τα προθέματα χρησιμοποιούνται για να υποδείξουν τον αριθμό κάθε στοιχείου που υπάρχει.
Σημαντικές σημειώσεις:
* Το πρόθεμα "Mono-" συνήθως παραλείπεται για το πρώτο στοιχείο. Για παράδειγμα, το CO είναι μονοξείδιο του άνθρακα, όχι μονοξείδιο του μονοκόμπαν.
* Ορισμένες ενώσεις έχουν κοινά ονόματα που δεν ακολουθούν τους κανόνες του προθέματος. Για παράδειγμα, το νερό (H₂O) και η αμμωνία (NH₃).
Παράδειγμα:διοξείδιο του άνθρακα
1. Στοιχεία: Άνθρακα (c) και οξυγόνο (o)
2. Προθέματα: Το "DI-" υποδεικνύει δύο άτομα οξυγόνου.
3. Φόρμουλα: co₂
Παραδείγματα άλλων ομοιοπολικών ενώσεων:
* νερό: Ετησίως
* μεθάνιο: Ch₄
* αμμωνία: Nh₃
* Διοξείδιο του θείου: SO₂
* Trichloride αζώτου: Ncl₃
Θυμηθείτε ότι οι ομοιοπολικές ενώσεις σχηματίζονται από την κοινή χρήση ηλεκτρονίων μεταξύ των μη μεταλλικών ατόμων. Αυτοί οι τύποι αντιπροσωπεύουν τη συγκεκριμένη διάταξη των ατόμων μέσα σε ένα μόριο της ένωσης.